烯醇和烯醇酯
醛醇加成和缩合反应
最后更新:2022年12月6日|
醛醇加成和缩合反应(碱催化)
的醇醛加成反应是an的加入烯醇化物到一个醛(或酮).用碱加热会导致水的流失从而形成新的碳碳键,形成我们所说的产物醇醛缩合产品。
类似的反应也可以发生在其他物种的烯醇化物上。它们有不同的名称,但基本过程是相同的。
目录
- Aldol反应(又名“Aldol加成反应”)
- 醛醇加成反应机理研究
- 醇醛缩合
- 交叉醛醇反应,
- 酮类的醛醇反应
- 分子内醛醇反应
- 反向Aldol反应-“复古Aldol”
- 总结
- 笔记
- 奖励:更多关于消除步骤的内容
- 附赠:Aldol反应的表亲(Knovenagel, Henry, Reformatsky)
- 测试你自己!
- (高级)参考资料和进一步阅读
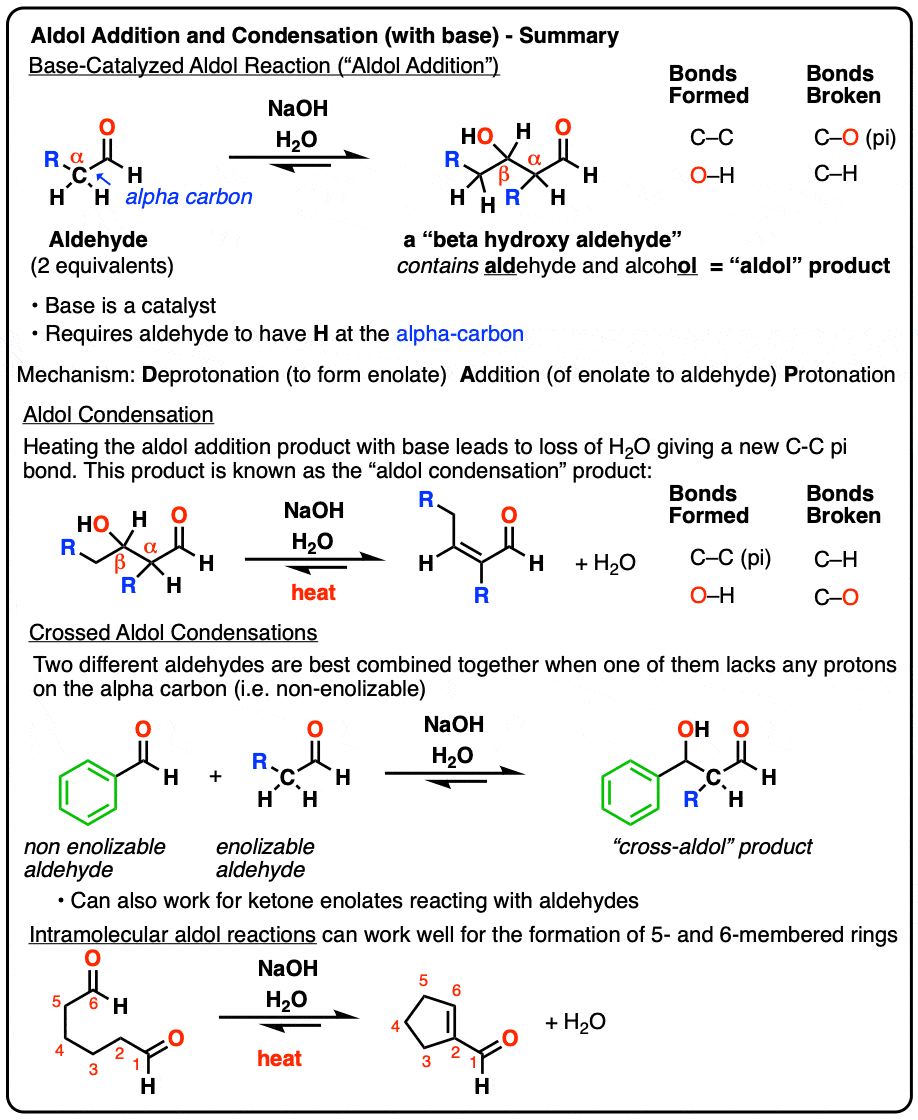
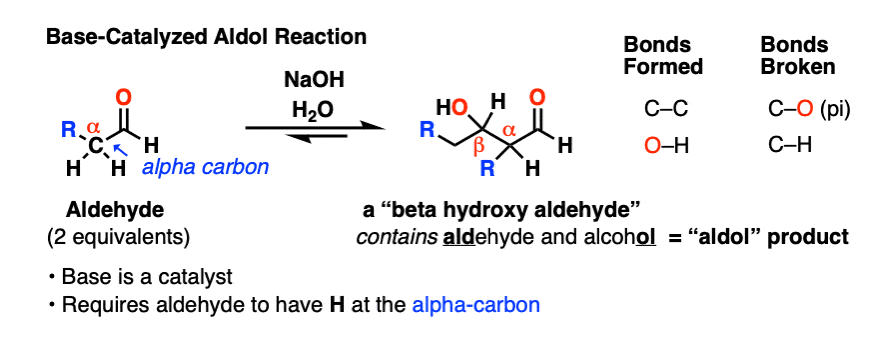
1.醛醇加成反应
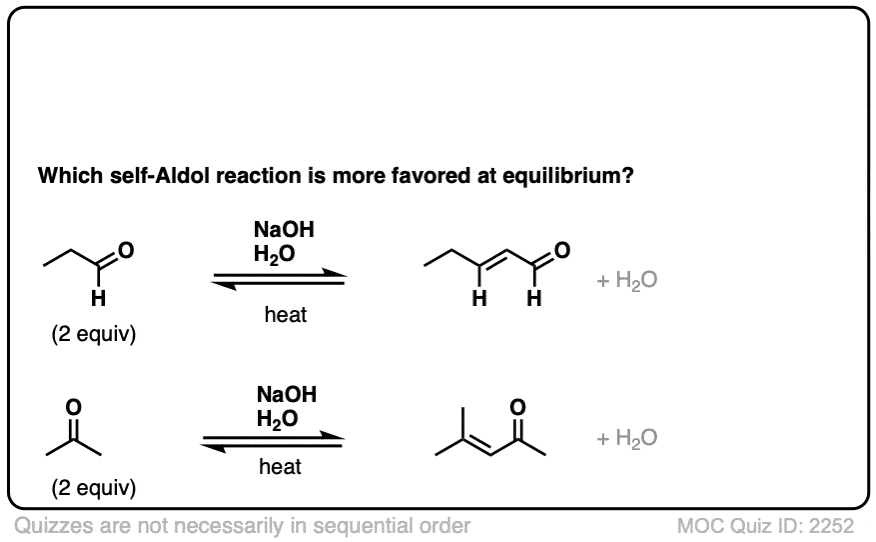
当某些醛用强碱处理时,起始物的两摩尔当量醛会形成新的碳碳键。由此产生的产物,β -羟基醛,包含“肾上腺脑白质退化症”乙醛和一个醇ol.
除了新的C-C键,还有一个C-H键断裂了,还有一个C-O (pi)键断裂了:
这种反应被称为醇醛反应或“aldol”除了反应”,以区别于失去水分形成新的碳碳双键的情况(这是羟醛缩合反应,看第3部分)
这种类型的反应也适用于酮(见下文)和其他官能团(见附录)。
在本文中,我们将重点讨论base-catalyzed醛醇的版本。酸催化的版本也存在;这是讨论(参见:酸催化醛醇反应]
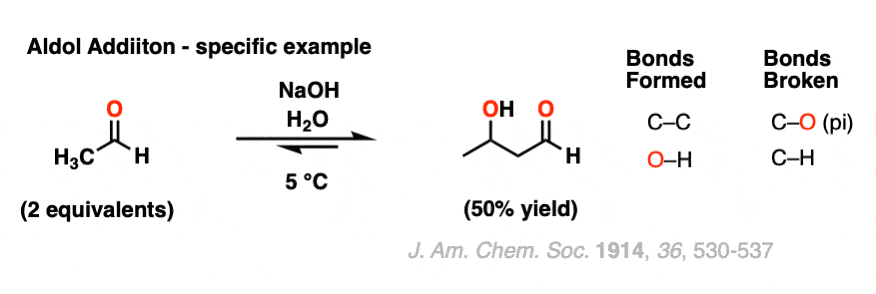
这是醛醇的一个具体例子加成反应,使用2个当量的乙醇(又名“乙醛”)。
2.醛醇加成反应机理研究
那么这个反应是如何进行的呢?这个基地的目的是什么?新的碳碳键是如何形成的呢?
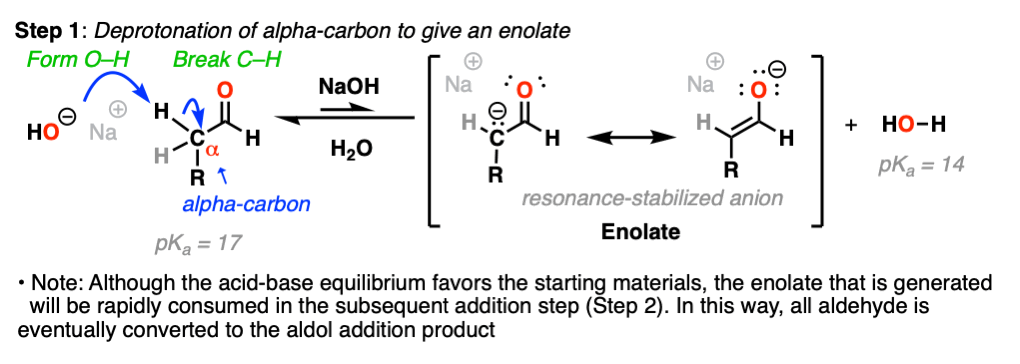
当考虑一个机制可能是什么样的时候,首先要注意的是我们使用的是强碱(NaOH)。
这就引出了一个问题:这里酸性最强的质子是什么?提示,它不是碳氢键醛!(这将导致酰基阴离子,而酰基阴离子不是共振稳定的)。
看看这些形成和断开的键,你应该能看到我们断开的是碳氢键紧邻的碳醛羰基(即“α碳”)。
强碱去除C-H键会导致共振稳定烯醇化物离子.(第一步,形成O-H,打破C-H)。
因此,醛醇反应的一个必要条件是醛是enolizable(即有一个质子在α碳).没有质子→没有烯醇化物→不使用羟丙醇。
悬停查看一些可烯醇化醛和非烯醇化醛的例子或者点击这个链接.
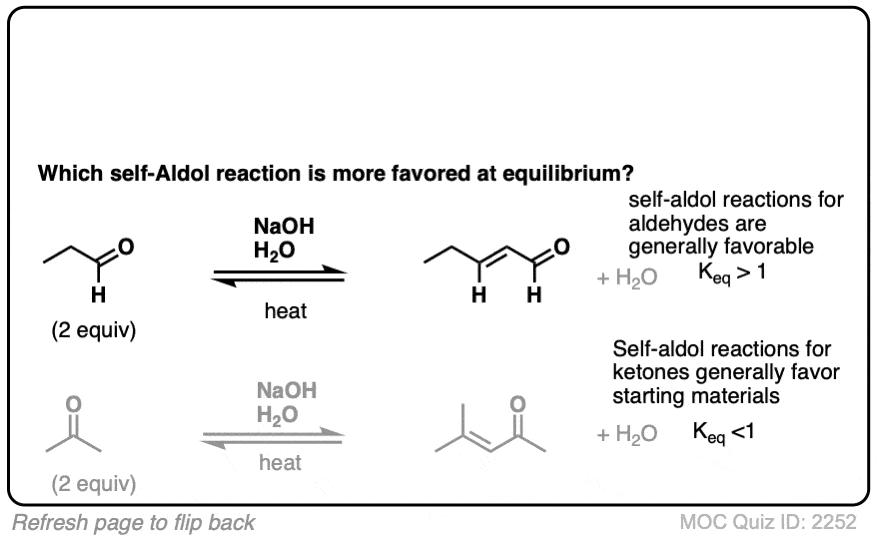
注意,酸碱平衡实际上有利于起始材料-我们使用的是NaOH (the共轭碱水,pK一个= 14),使其更坚固烯醇化物,共轭碱乙醛,pK一个= 17).
反应的关键是烯醇化物,一旦形成,就是极好的亲核试剂并能迅速反应任何可用的亲电试剂在溶液中徘徊,比如,醛。
产品要求我们形式碳碳和打破切断(π)。
的烯醇化物这样就增加了醛在步骤2中(形成C-C,打破C-O (pi)),这是最经典的机械步骤的例子金属羰基合物,加法。
就这样,一切开始醛最终转化为醛醇加成产物,尽管酸碱平衡不利。
后加成反应时,氧上产生的负电荷就会发生质子化作用通过溶剂(步骤3,形成O-H)。
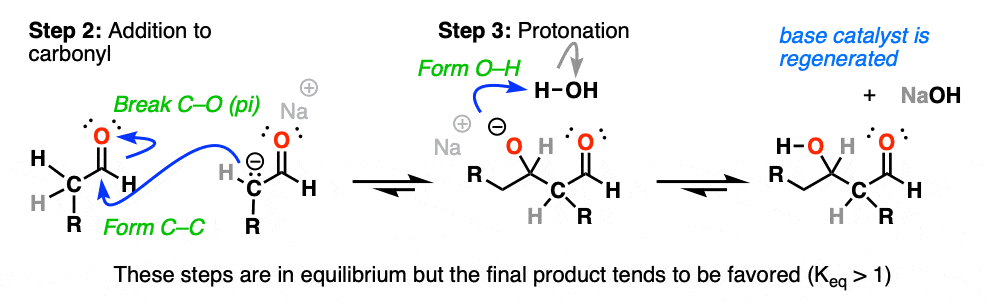
如果你之前学过醛和酮的反应,希望这一系列的反应看起来很熟悉。
这是又一个经典的例子两步机制(加成-质子化)到醛烯醇化物作为亲核试剂.(好吧,好吧,如果你数的话,是3步烯醇化物形成).[参见:醛和酮- 14反应遵循相同的机制]
在这些条件下,注意所有3个步骤都处于平衡状态。对于醛类,平衡通常有利于最终的醛醇加成产物。[注1]
3.醛缩合反应
但这还不是全部!羟碘醇可不止是一种无聊的加成反应.
如果由此产生的醛醇加成产物(β -羟基醛)与碱加热,它会失去水分,形成新的碳碳键。
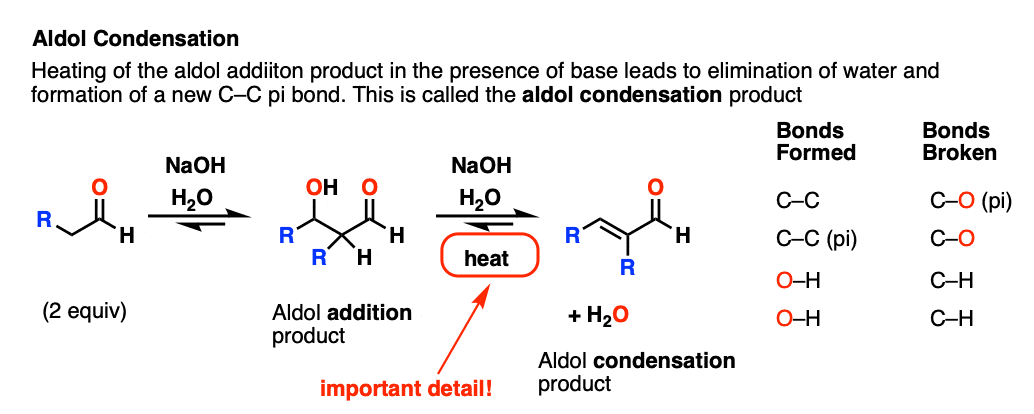
我们破坏了碳氢键,破坏了碳氢键,形成了碳氢键。
这被称为醛缩合反应因为水是作为副产品形成的。
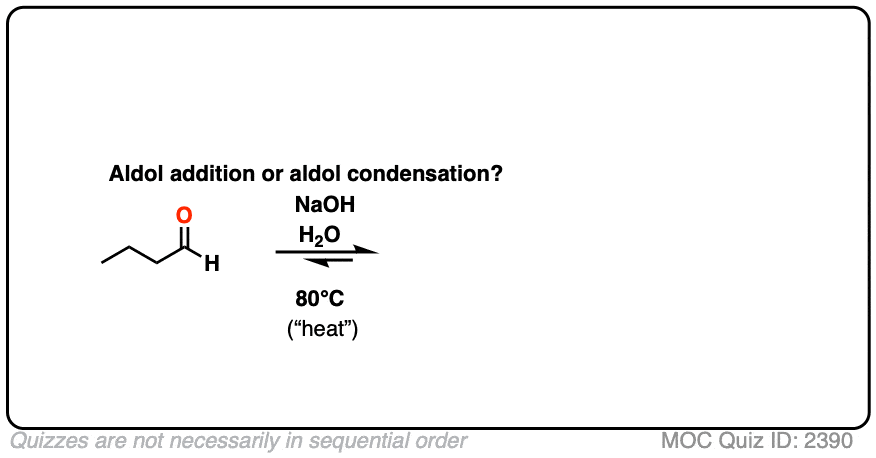
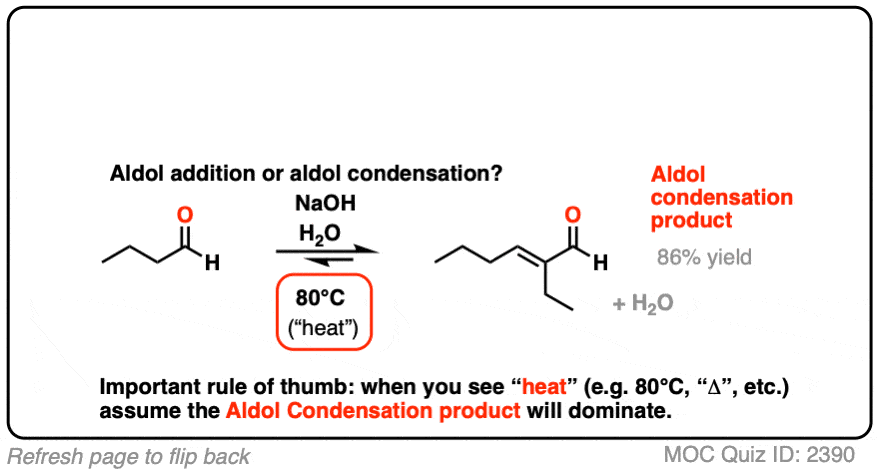
对于我们来说,最重要的区别因素是“热”,这往往有利于消除反应。[看到的:热有利于消除反应]
给所有读到这篇文章并打算在考试中测试这篇材料的人一个提醒:如果你看到“heat”,假设你需要画出冷凝产物。
对于两个经典的“现实生活”例子,比较相同反应在低温(0-5°C)和“高温”(80°C)下运行的主要产物。
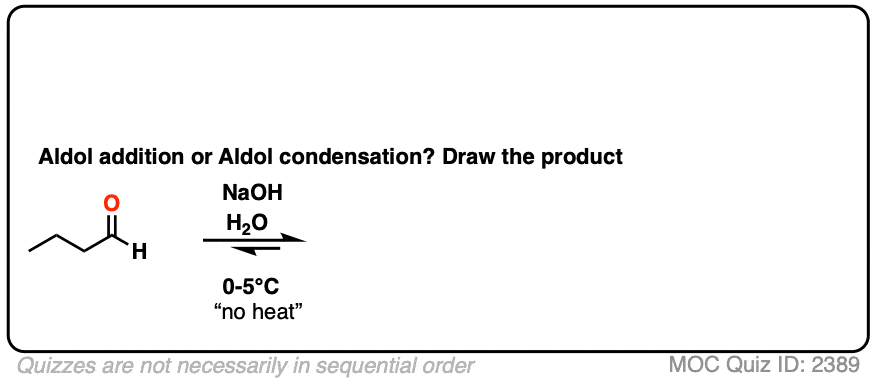 点击翻转
点击翻转
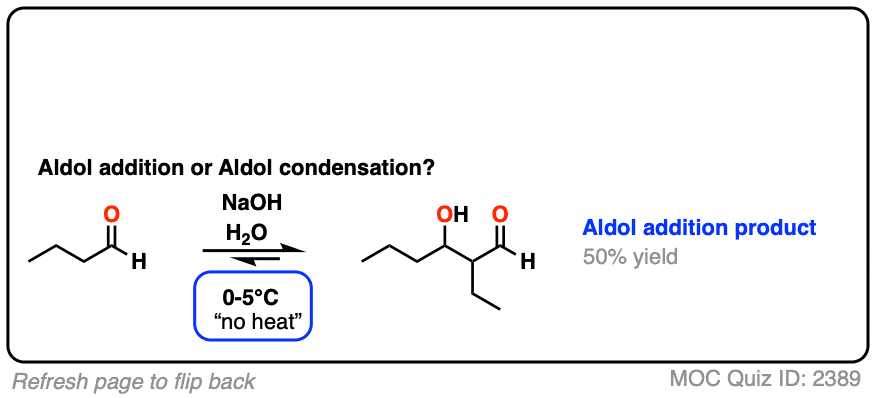
 点击翻转
点击翻转
(见注2供参考)
在现实世界中,还有其他因素可以决定产品的分布,但是“热从“有机化学概论”的角度来看,这是最重要的一个。[注3]
消去步骤是这样工作的,是一个例子E1CB反应-不是E2!更多讨论见附录[注意4.]
4.交叉反应
到目前为止,我们只讨论了“自醛醇”反应,即两个相同的等价物醛结合起来就会产生一种新产品。
让我们进行下一个合乎逻辑的步骤。为什么不把两者结合起来呢不同的醛吗?
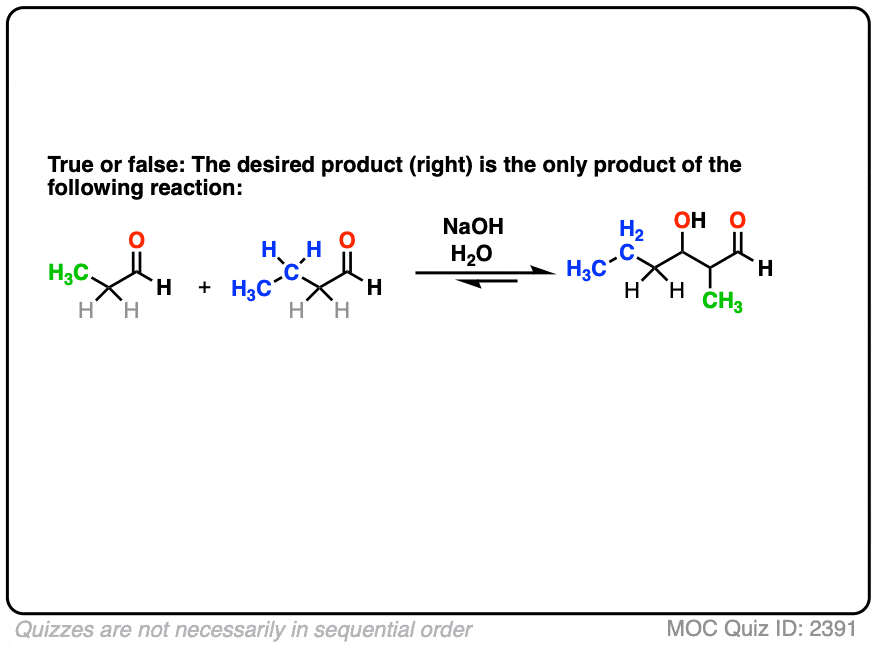
举个例子,假设我想要下面的两个醛生成产物正确的通过醛醇反应。
所以我在溶液中加入两种醛,加入我的催化碱,抬起我的脚,等待反应完成,相信宇宙会解决问题。
不可能出什么差错。正确的?
 点击翻转
点击翻转
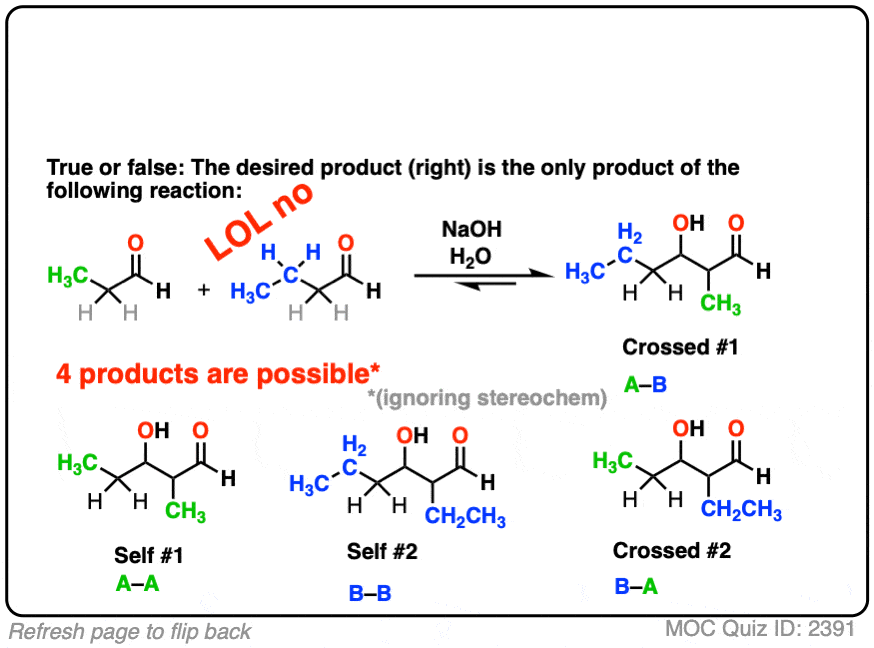
当然只是开玩笑。它是化学。很多事情都可能出错!
首先,如果我们有两个enolizable醛存在于溶液中,那么我们就有可能形成两种不同的烯醇酯。
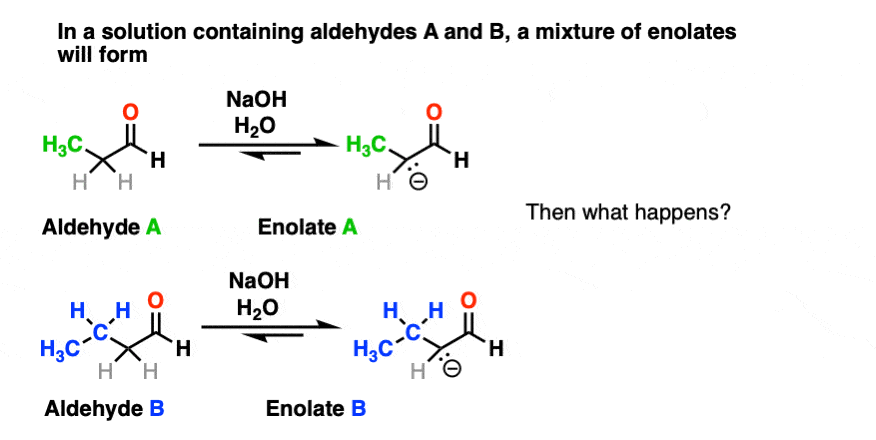
其次,由于我们使用的是催化碱,所以周围有大量的醛。
每一个烯醇化物,反过来,可以与两种醛中的一种反应,产生两种“自醛醇”产物和两种“交叉醛醇”产物。
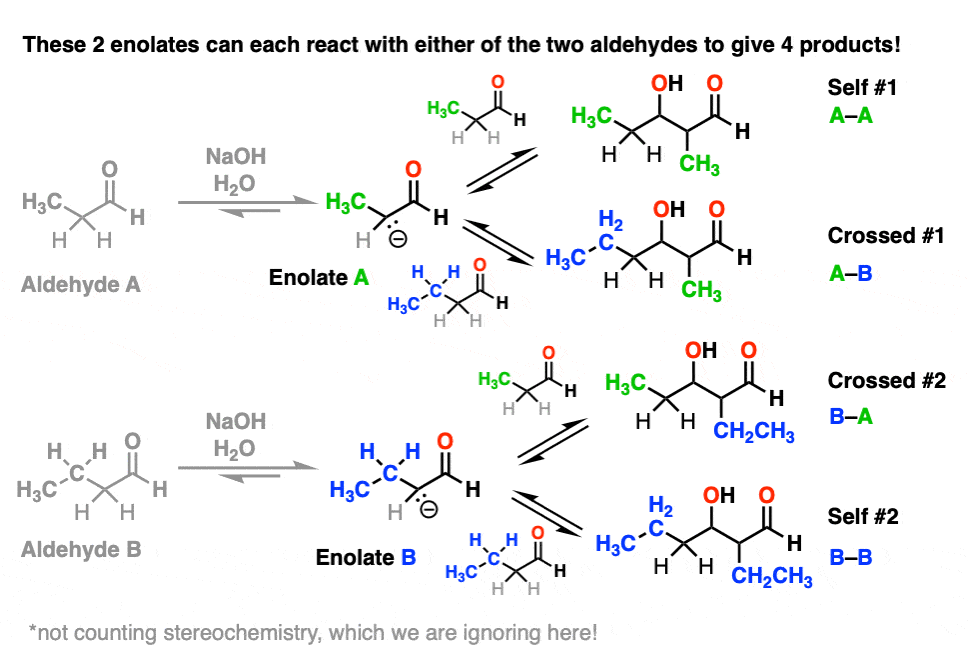
注意,不是所有的产物都是等量的,但这仍然是4种产物。
(我们在这里忽略立体化学会让事情变得更简单。[注5]
这个结果就是化学家们所说的BFM反应。委婉地说,它代表大混乱。尽管这个现实生活中的例子(1914年)实际上还可以:[注6]
悬停查看一个真实的例子或者点击这个链接.
事实是,没有人愿意进行一个反应同时产生4种不同的产物。分离混合物是一项耗费大量时间的工作,每个化学家都尽量避免。
那么,怎样才能更有效地完成这样的工作呢?
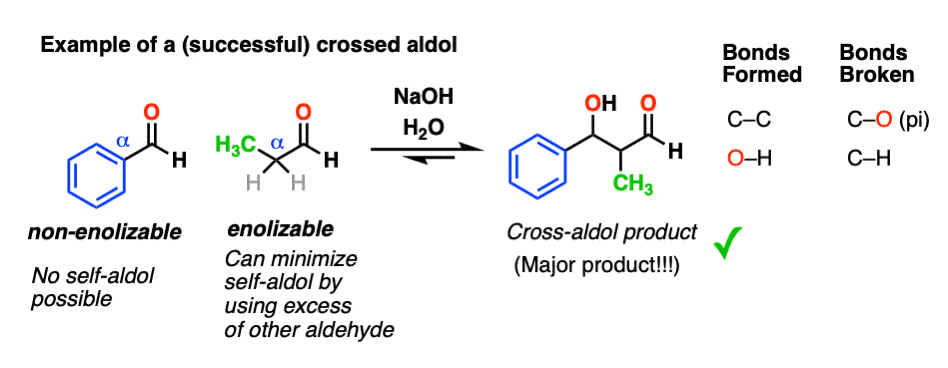
一种方法是雇佣非enolizable醛作为反应伙伴之一。这样就只有一个了烯醇化物亲核试剂担心。
这使得醛醇反应更容易预测——特别是当我们使用过量的非醛时enolizable醛尽量减少自我反应。
5.酮类的醛醇反应
烯醇酯也可以由酮,酮类也可以是醛醇反应中的亲电试剂。
这是自醛醇反应丙酮例如。
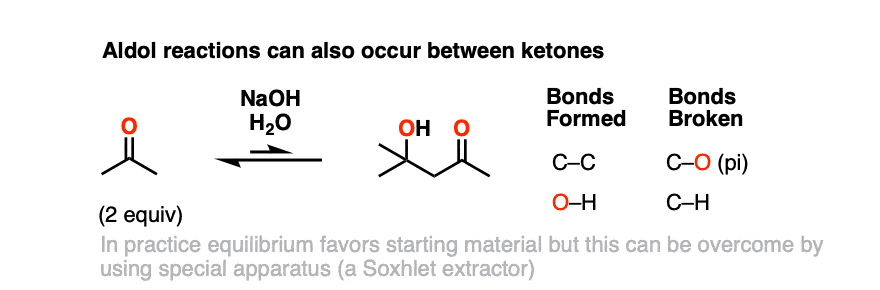
在实践中,自醛的丙酮不是很好,平衡倾向于起始物质,但是使用一种叫做索氏提取器,可以在合理的产率下分离出产品。
当我们讨论这个话题时,值得注意的是酮是g一般比醛对亲核试剂的反应性弱,如羰基碳在空间上受到的阻碍更大,电子也更丰富(烷基基团可以释放电子——回想一下,它们是弗里德尔-克拉夫反应中的“活化剂”).
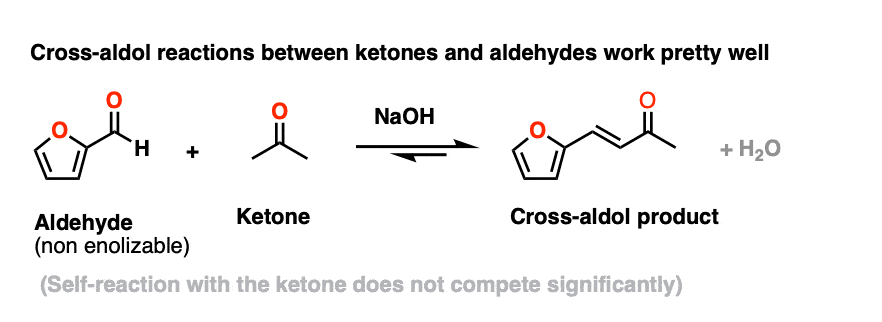
但是,使用酮烯醇化物(由base构成的)作为亲核试剂用于醛醇与非enolizable醛效果非常好。有这么多的例子,它有自己的名字- the克莱森施密特凝结,你不需要知道这些。
这是一个来自有机合成的例子。(Self-aldol丙酮不存在任何显著的竞争)
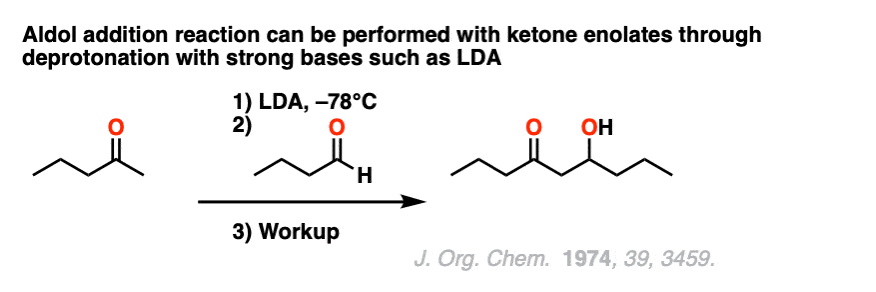
另一种反应方式是酮烯醇是预形成的烯醇化物具有坚固,粗大的基础,如锂diisopropylamide(乔治。),然后加入醛.
[请注意7]
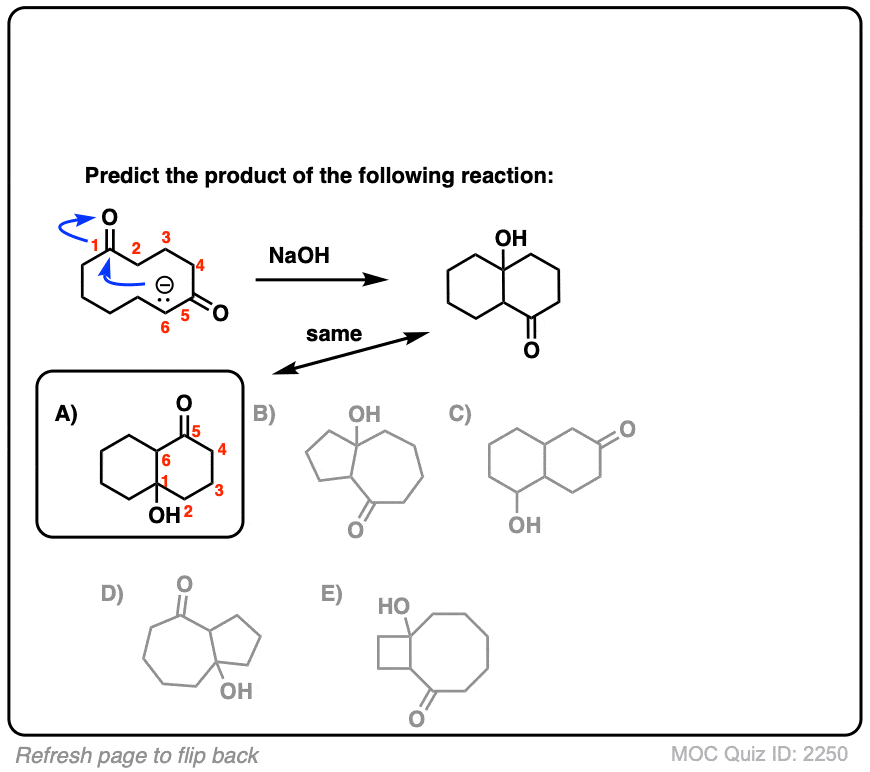
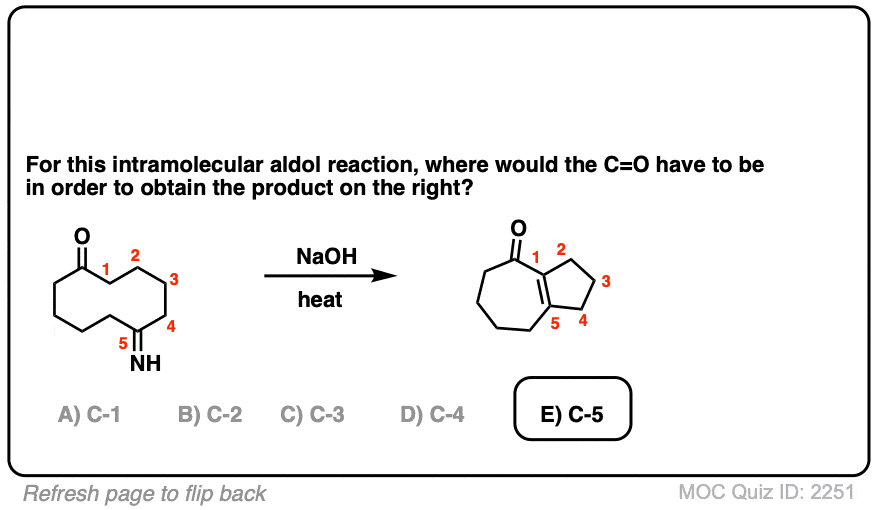
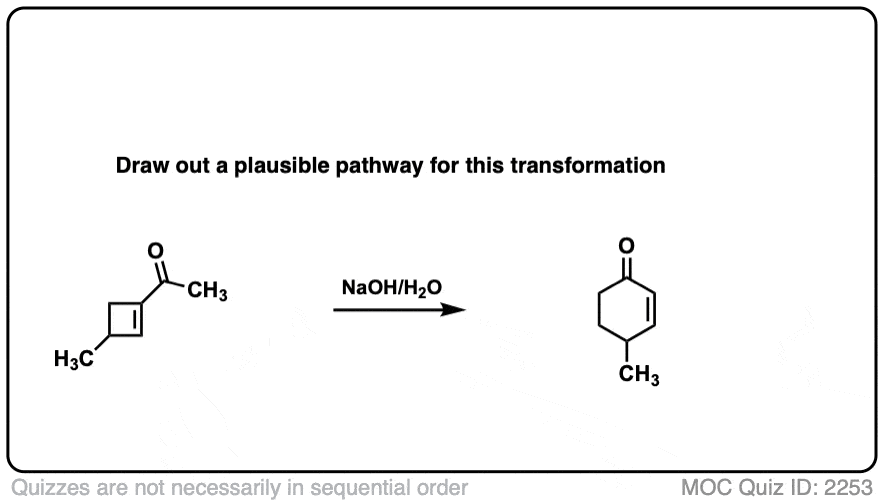
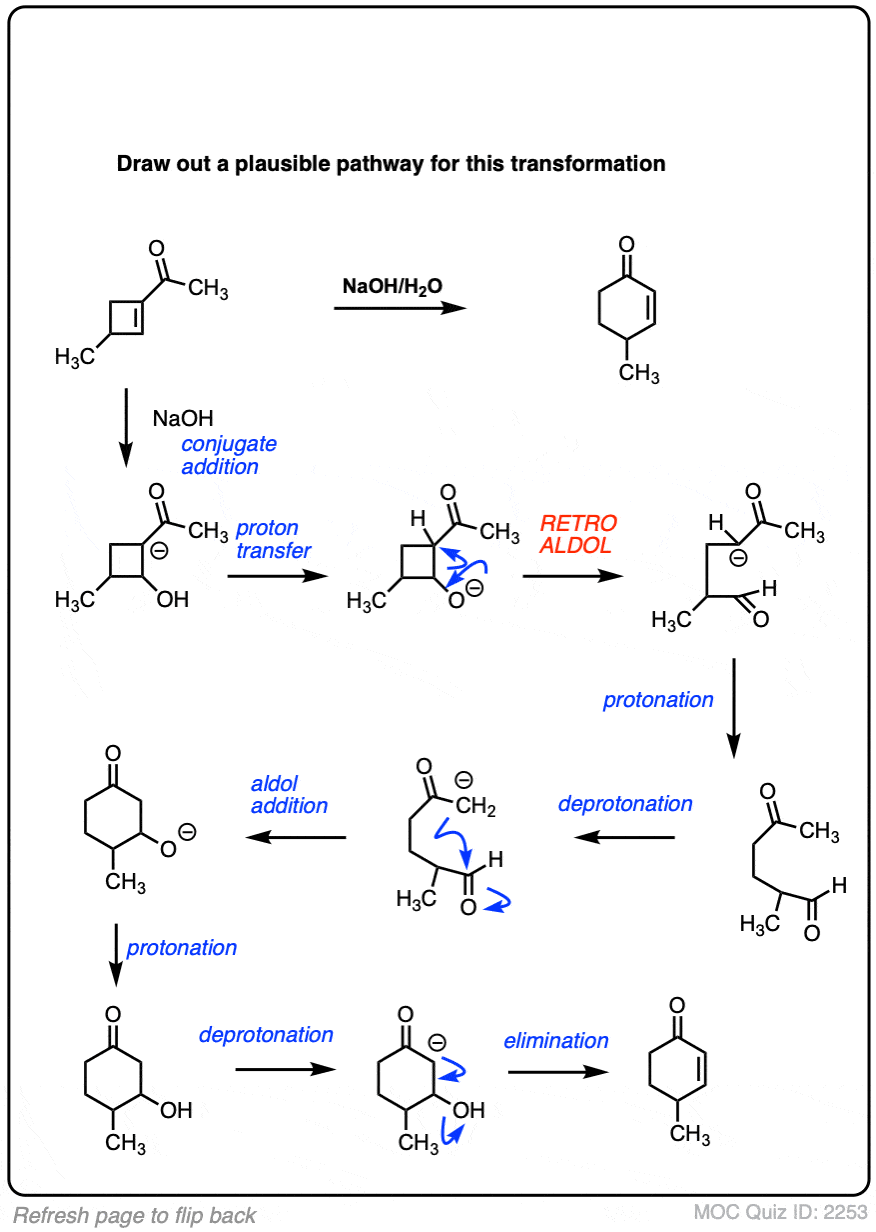
6.分子内醛醇反应
我总是告诉学生要期待看到分子内的考试时的反应,因为老师们知道这是一种很好的方法,可以测试你对给定反应的理解程度,而不需要他们介绍任何新概念。
如果我省略了一些例子,那就是疏忽了分子内的醛醇反应,当能形成5元环或6元环时效果最佳。(提醒- 5元环和6元环具有最小的环应变).
看看这个例子:
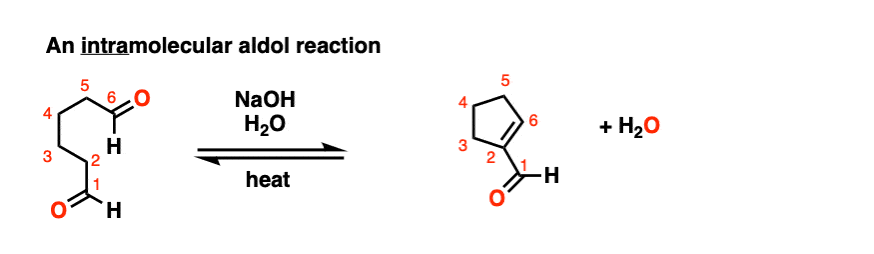
[裁判注意,在分子间的情况下,形成或断开的键没有区别(形成C-C,断开C-O (pi),断开C-H)。自从新成立的烯醇化物和醛在同一个分子上,必然会形成一个环。
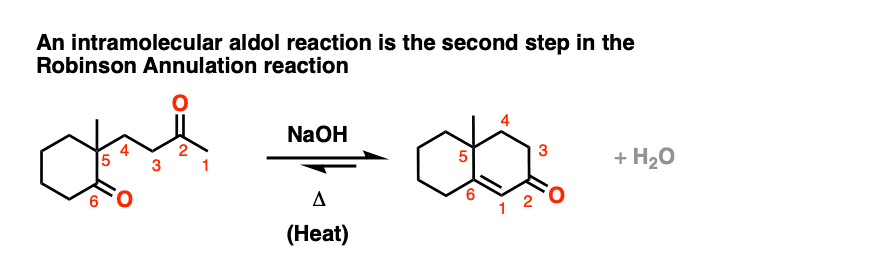
分子内醛醇缩合的一个常见应用是在罗宾逊环化反应的第二步。
[也:看到帖子:鲁滨逊环结]
分子内醛醇反应的几个例子在“自我测试”部分。
7.反-醛醇反应(醛醇反应的可逆性)
醛醇反应是平衡的。一般来说,对于醛,反应有利于最终产物,而不是起始材料。
然而,有时也有可能让反应反过来。
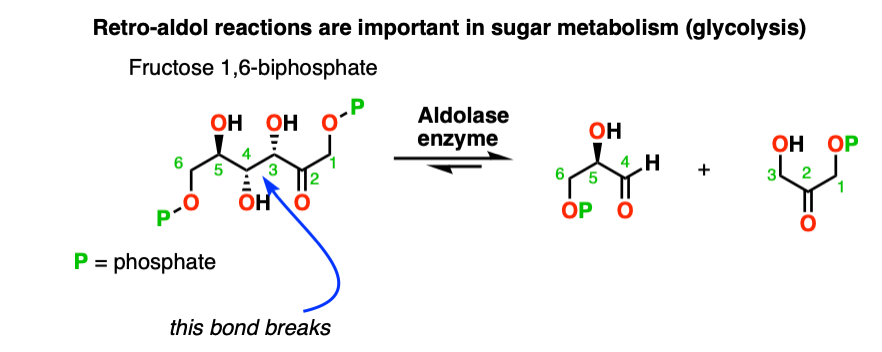
这有时被称为retro-Aldol的反应。这是一个由环应变释放驱动的反醛醇反应的例子
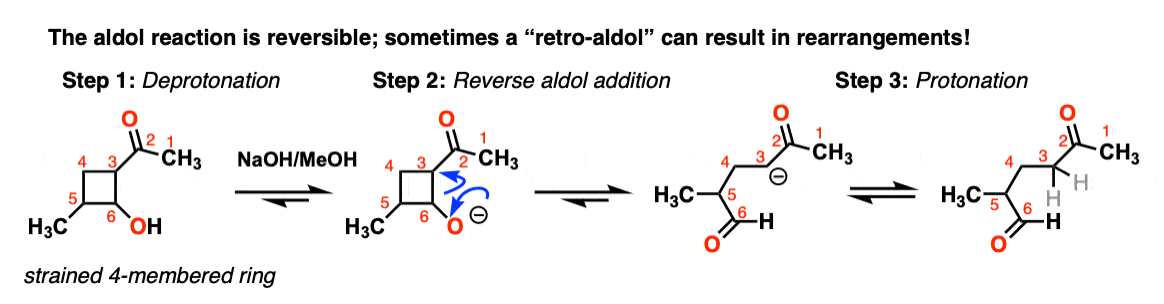
(请注意,最初的起始材料不是通过醛醇制成的)。
甚至有酶(称为“醛缩酶),可以促进反醛醇反应,如糖酵解。[注8]
8.总结
- 的base-catalyzed醇醛除了反应是an的加入烯醇化物到一个醛(通常)。
- 如果加热,则会进一步失水并形成新的双键,从而生成醛醇冷凝产品。
- 交叉醛醇反应最有效enolizable醛与non-enolizable醛随着亲电试剂.酮烯醇酯也是醛醇反应的优良亲核试剂。
- 酮的自醛醇反应可以发生,但它们比醛的自醛醇反应要不利得多(产物的空间位阻更大)。
- 注意分子内醛醇缩合反应,特别是当可以形成5元环或6元环时。
- “反-醛醇”反应是-羟基酮或-羟基醛的碎片,它们会被还原烯醇化物/醛起始原料。
- 醛醇反应也可以被酸催化,在那里它通过一个烯醇中间。想了解更多,在这里看到的。
笔记
注1.一项研究测得平衡常数K约为400 [裁判].平衡常数随着产物中空间位阻的增加而减小醛变得更加分支)。
注2.第一反应是来自江淮191436岁,530年。第二种反应来自Grignard & Vestermann,牛化学。Soc。Fr.第四部分,192537岁的425.网上很难找到,但在综合有机合成.
注3.当芳香醛在加成阶段反应很难停止,因为双键通过与芳香环缀合会相当稳定。
注意4.在最近对醛醇缩合机理的研究中,损失了离去基团确定HO(-)为速率决定步骤。[裁判].
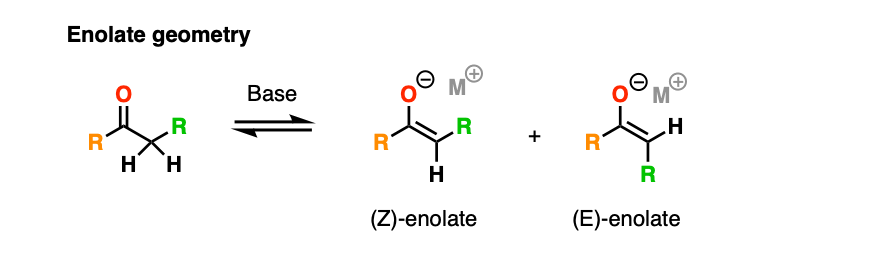
注5.为了简单起见,我们在这篇文章中省略了立体化学。我还画了烯醇化物作为碳原子,而不是(更正确的)平面几何,氧上带负电荷。
与烯醇化物这样画,一个特别重要的细节是几何烯醇化物,可以是E或Z。
1957年,齐默尔曼和特克斯勒提出了一个模型,通过一个封闭的6元椅状过渡态来预测醛醇的立体化学(和相关反应)米氧的坐标烯醇化物和醛.
在这个模型中,能量最低的过渡态往往是体积较大的R基团所占据的状态赤道“椅子”上的位置。
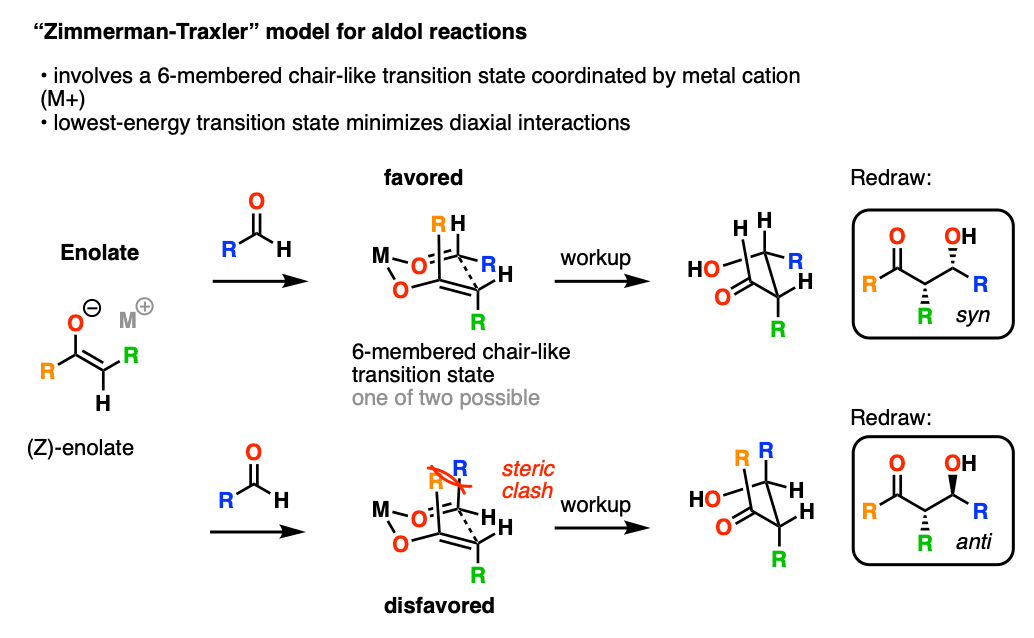
金属M对立体选择性有很大的影响。O-M键越短,“椅子”过渡态越压缩,立体选择性越大。特别是,醛醇与烯醇酸硼的反应表现出了惊人的立体选择性。
注6.这个例子发生在1914年,在现代光谱和分离技术使识别所有的反应产物成为可能之前。主要产品的蒸馏率为54%,这实际上是一个相当好的结果!一个古老的概括称为" Lieben规则"指出主要的醛醇产物来自于"更多取代物"的附着烯醇化物致“较少被取代者”醛.
请注意7.这是一个经典的醛醇反应的例子酮烯醇化物和一个醛使用二异丙酰胺锂(乔治。),以形成“较少取代的”烯醇化物.[裁判]
注8.反醛醇反应实际上是糖代谢的一部分!在体内,1,6-果糖二磷酸通过醛缩酶的作用被裂解,生成甘油醛3-磷酸和二羟基丙酮磷酸。
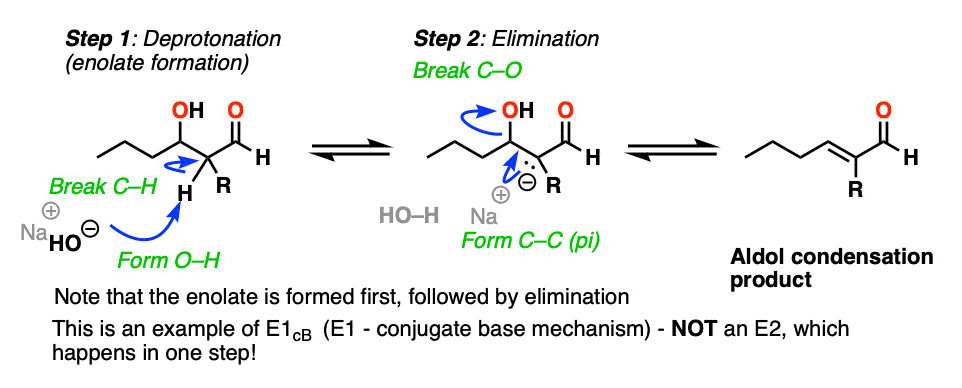
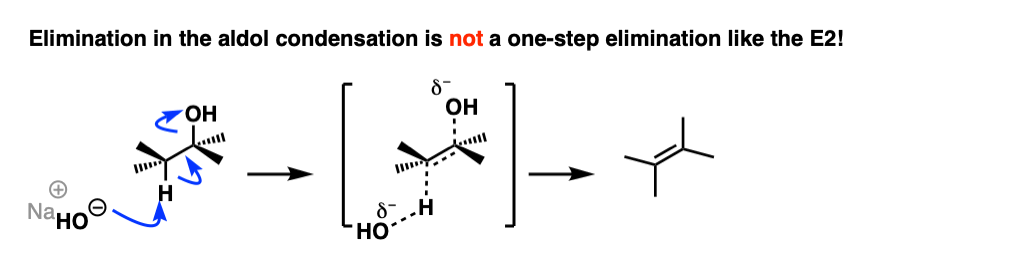
醛醇缩合反应中的消除步骤
那么“排除”步骤是如何工作的呢?
首先,为什么HO(-) a离去基团?它不是一个强碱吗,因此是个坏的离去基团?是的,它是一种强碱,一般来说不是好碱离去基团在消去反应中。然而,这并不典型消去反应.
第一直觉可能会认为这是一个E2反应,因为我们用的是强碱。
这实际上不是E2反应,因为不协调!
这是一个例子E1CB(消除,单分子速率测定步骤,经共轭碱).[看到帖子:E1cB机制]
在强碱(例如氢氧根)的存在下,共轭碱水,pK一个14),烯醇化物能由羟基形成吗醛(pK一个大约17-18岁)。
注意烯醇化物产品实际上是比氢氧根离子更强的碱,所以平衡在反应物的一边。
的烯醇化物是一种可以观察和分离的中间体(不像化学中的双分子过渡态)E2!)
现在,如果你把负电荷想象成粘在p轨道上的碳上,想象p轨道和相邻的C-O sigma*键重叠。如果重叠足够,那么一个新的C-C (pi)键可以随着C-OH键的断裂而形成。
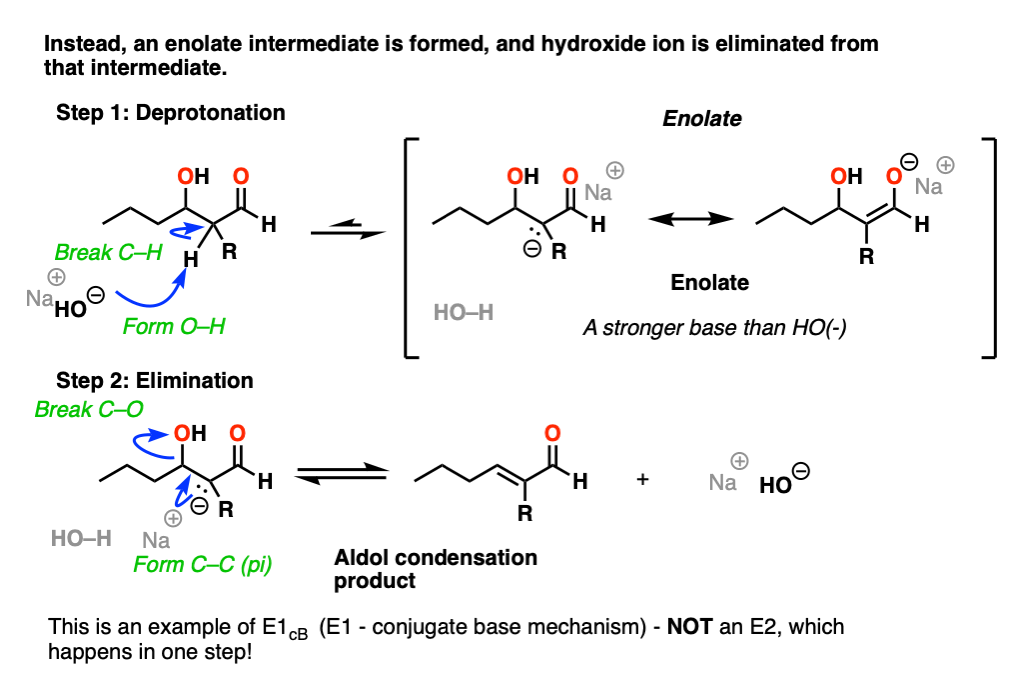
在第二步中,我们实际上是从a强大的基础(烯醇化物)到较弱的基础(氧化)。
所以是的,氢氧根离子是强碱也是坏碱离去基团,但从酸碱的角度来看,排出NaOH的反应实际上更有利(强酸+强碱- >弱酸+弱碱)。
此外,产物还与C=O键形成了一个新的双键,该双键是稳定的。
Aldol反应的表亲- Knovenagel, Henry, Reformatzky和其他变体
在这篇文章中,我们讨论了醛和酮烯醇酯的反应,但也有可能形成其他“烯醇酯”。这可能应该是另一篇文章,但其机制几乎都非常类似于醛醇,所以在这里简要介绍一下。(第一步-形成烯醇化物;第二步——加法羰基,然后是第三步-质子化,然后在某些情况下是消除)。
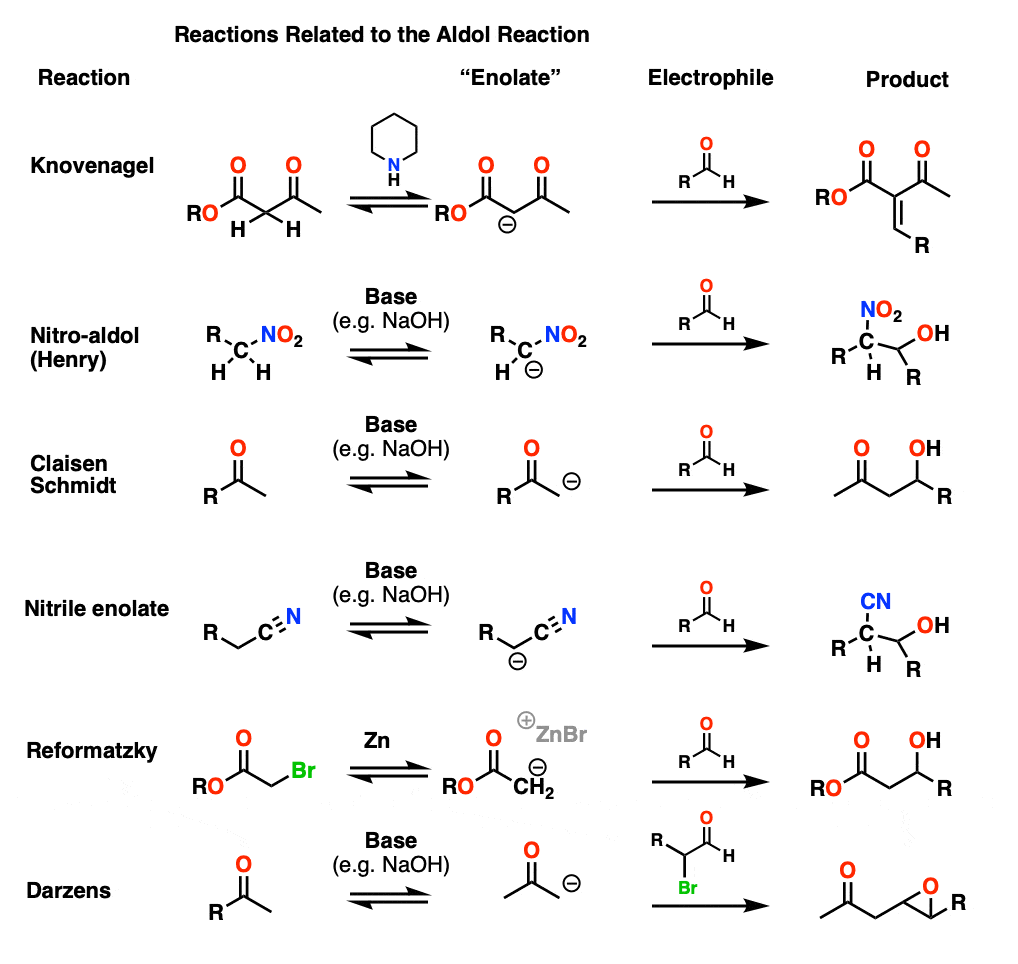
Knovenagel凝结
在诺维纳格尔缩合反应中,一个-酮酯(或类似)化合物经温和碱(常使用哌啶)处理后形成烯醇化物,然后攻击一个醛.由于α质子通常呈酸性(pH值约为12),水分的流失通常非常快。
亨利的反应
在硝基-醛醇或亨利反应中,与NO2基团相邻的碳被去质子化,形成类似于an的物质烯醇化物.
Claisen-Schmidt
在Claisen-Schmidt(名字不重要记住)中酮烯醇化物形成并添加到醛.
腈烯醇化物
相邻的碳腈也可能被去质子化,尽管与pK一个大约30,使用氢氧化钠是一种延伸。从本质上讲,这与典型的醛醇反应没有什么不同。
Reformatsky反应
在Reformatsky中,从α -溴开始酯然后用细小的锌粉处理。这和形成格氏试剂很像,只不过得到的碳离子是an烯醇化物!的烯醇化物然后可以加到醛或酮.
Darzens反应
这个有点奇怪,一个带光环的醛醇醛作为亲电试剂.在添加了烯醇化物,结果是醇盐就能形成环氧通过年代N2 C-Br键的位移(见这篇文章上)环氧化合物的合成)。醛醇反应基本上会生成一种卤素醚,然后突然合上产生环氧.
测试你自己!
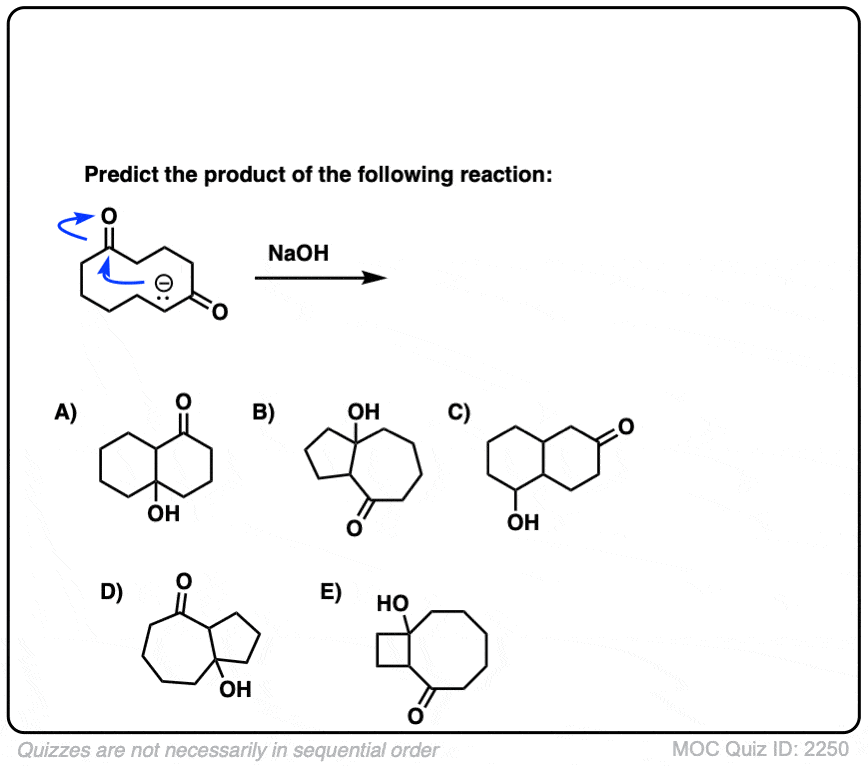 点击翻转
点击翻转
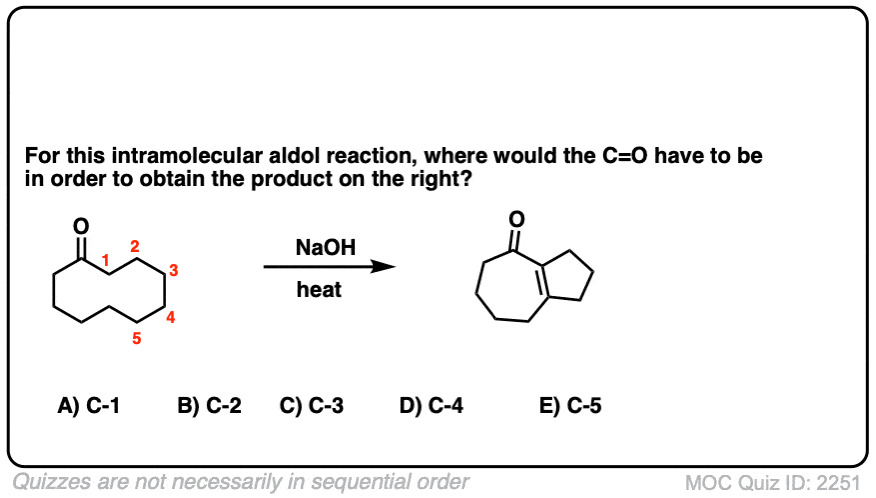 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
(高级)参考资料和进一步阅读
(高级)参考资料和进一步阅读
希斯考克的评论综合有机合成,卷2。Pp 139-177对于发现醛醇反应的有用文献非常有用。推荐。
- 缬醛酸钠
a·鲍罗丁
j . Prakt。詹。186493(1), 413 - 425
DOI:10.1002 / prac.18640930168
亚历山大·鲍罗丁在1864年首次发表了“醛醇”化学领域的文章。本文涉及戊醛(C5H10O)与钠结合,得到我们现在所说的醛醇缩合产物。1872年的一份后续报告涉及用盐酸处理丁醛,以获得与Wurtz报告的产品类似的产品。
这篇文章有鲍罗丁丰富多彩的生活的历史细节;除了因化学而闻名,他还是一位受欢迎的作曲家,他的作品至今仍在演奏。 - Sur一个aldéhyde-alcool
武茨,文学硕士。
牛詹。Soc。Fr。1872, 436年
没有DOI,但这里是满的链接
Adolphe Wurtz研究了用盐酸在低温下处理乙醇,并得到了一个新的"醛-酒精产品C4H8O2.“Ce corps est l”醛-alcool qui fair l ' object de cette note et que je nomerai par缩写醇醛从那时起,“aldol”这个名字就一直伴随着我们。 - 缩合反应[酮与醛的缩合反应]
l·克莱森;Claparede,。
的误码率。1881年,14(1): 2460 - 2468
DOI:10.1002 / cber.188101402192 - " Ueber die Einwirkung von Aceton auf Furfurol und auf Bittermandelöl in Gegenwart von alkilauge "[关于丙酮碱氢氧化物存在下糠醛和苦杏仁油(苯甲醛)的研究]
施密特,j.g.。
化学。的误码率。1881年,14(1): 1459 - 1461
DOI:10.1002 / cber.188101401306
两者之间的反应醛或酮有一个带有芳香基团的α-氢羰基缺乏α-氢的化合物称为Claisen-Schmidt缩合。这种反应以其两位先驱研究者Rainer Ludwig Claisen和J. G. Schmidt的名字命名,他们分别在1880年和1881年发表了关于这一主题的文章。 - 醛醇缩合的完整机理
查尔斯·佩兰和张桂林
有机化学杂志2016年,81(13), 5631 - 5635
DOI:10.1021 / acs.joc.6b00959
碱催化苯乙酮与苯甲醛交叉醛醇反应生成查尔酮的一个很好的机理研究。本文通过观察D反应速度较快,确定HO(-)的最终消除是该反应的限速步骤2O比H2O(溶剂同位素效应)。 - 生长素a和生长素b相关化合物的研究。第三部分。生长素b环戊烯基类似物的制备及其性能内酯
j·b·布朗,h·b·亨贝斯特,e·r·h·琼斯。
j .化学。Soc。1950, 3634 - 3641
DOI:10.1039 / JR9500003634
这是分子内醛醇缩合的一个很好的例子。 - ”两种酮的混合缩合很少用于制备。希斯考克,c.h.综合有机合成卷。2。第1.5节“醛醇反应:酸和一般碱催化”。页133 - 179。请看下面Guthrie的论文,其中醛醇缩合的平衡常数为0.039(即有利于起始材料)。通过将醛醇产物从碱中分离出来,可以得到较好的产率索氏仪器。
- 乙醛缩合醛醇反应的平衡常数和氢氧根催化反醛醇反应的速率常数
彼得·格思里
可以。化学52,2037(1974).f
DOI:https://doi.org/10.1139/v74-294
“对乙醛醛缩合反应平衡常数的间接热化学估计表明,该反应的不可逆性远低于人们所认为的……平衡常数为4.0 × 102米-1....焓变是-9.84千卡/摩尔。”[A calculation for ΔG° based on these parameters gives -3.55 kcal/mol]
对醛醇缩合的类似研究丙酮导致平衡常数为0.039(即有利于起始材料)和ΔG°的值为+ 1.92 kcal/mol。裁判. - 伊万诺夫和重整斯基反应的立体化学。我
霍华德·e·齐默曼和玛乔丽·d·特克斯勒
美国化学学会杂志195779(8), 1920 - 1923
DOI:10.1021 / ja01565a041
醛醇反应的齐默尔曼-特克斯勒过渡态模型,已被证明在合理化(和预测)立体化学结果方面非常有用。 - 醛类的第一次直接对映选择性交叉醛醇反应
艾伦·b·诺瑟普和大卫·w·c·麦克米伦
美国化学学会杂志2002124 (24), 6798-6799
DOI:10.1021 / ja0262378
两个醛的交叉醛醇反应烯胺而不是烯醇化物中间体,使用氨基酸l -脯氨酸作为催化剂。
现实生活中的例子:
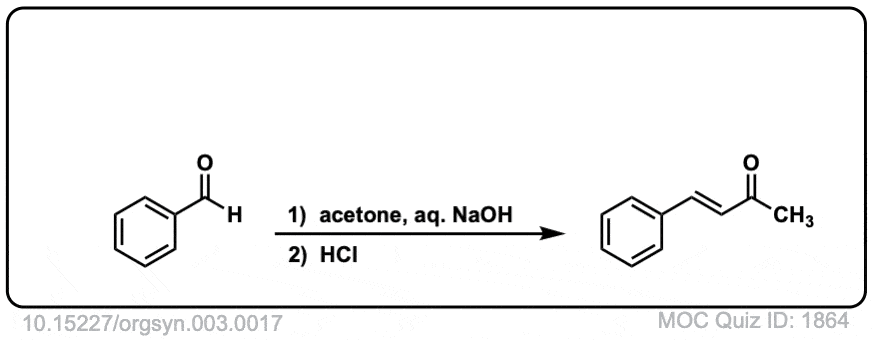
Org。合成,1923,3,17
DOI链接:10.15227/orgsyn.003.0017
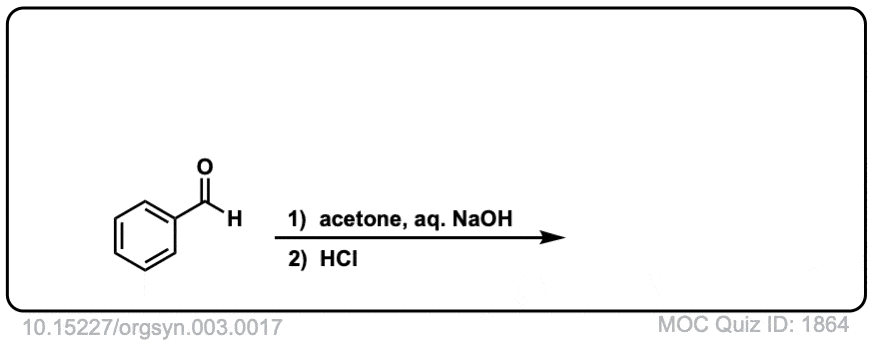 点击翻转
点击翻转
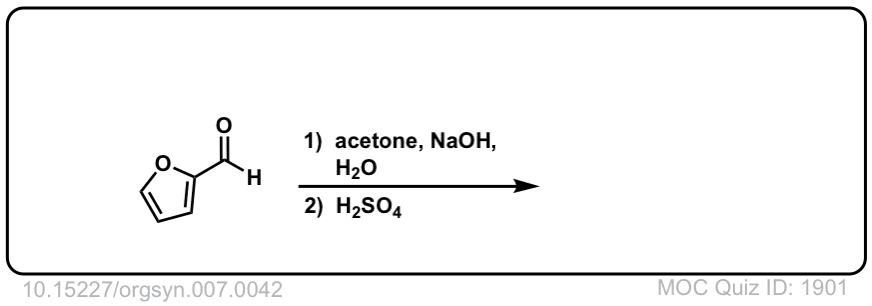
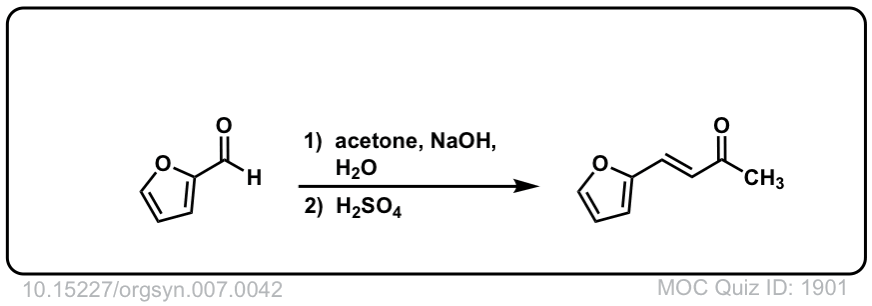
Org。合成,1927,7,42
DOI链接:10.15227/orgsyn.007.0042
 点击翻转
点击翻转
Org。合成人,1932,12,22
DOI链接:10.15227/orgsyn.012.0022
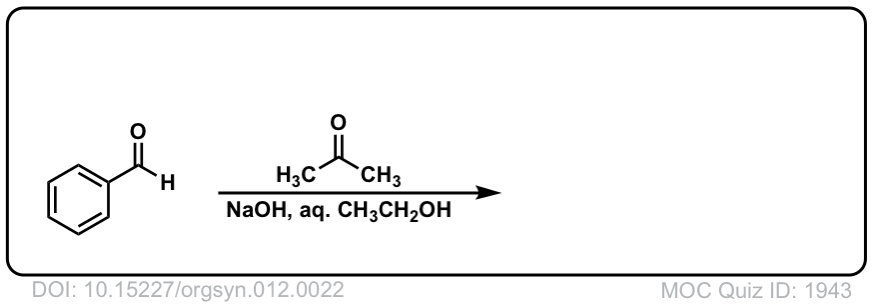 点击翻转
点击翻转
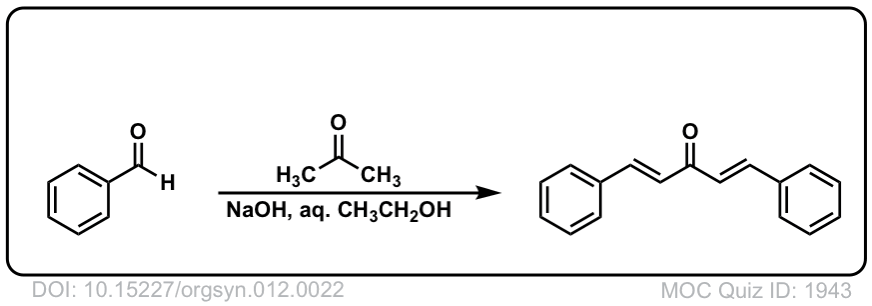
Org。合成,1951,31,35
DOI链接:10.15227/orgsyn.031.0035
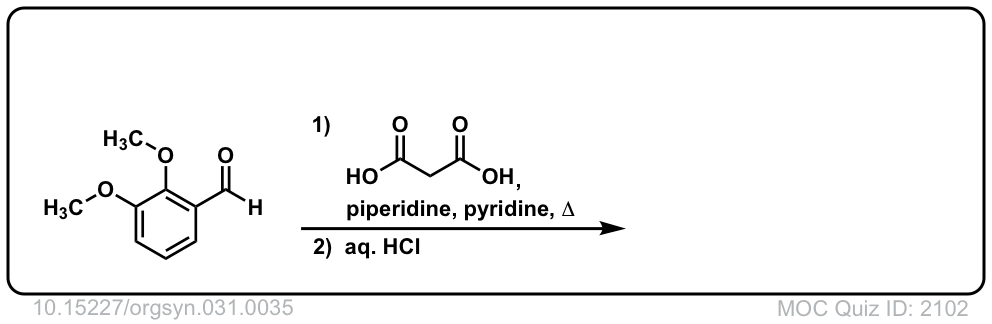 点击翻转
点击翻转
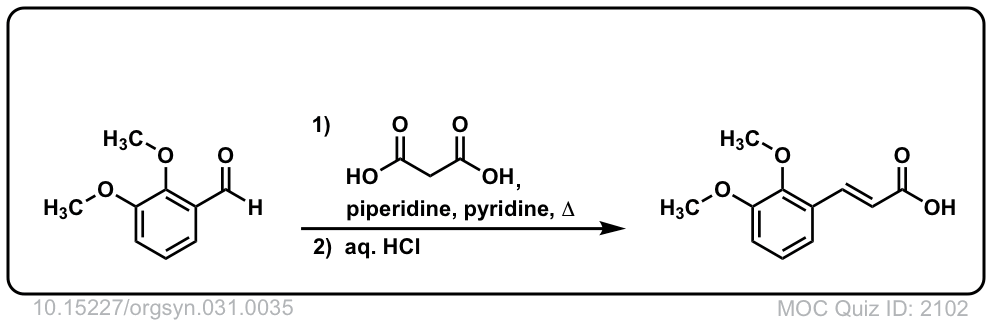
非常神奇的
感谢注释8关于醛缩酶。我对1,6-果糖二磷酸为什么是醛醇感到困惑,因为教科书上总是把它画成环状。现在有很多道理了!
很高兴你发现它对你有帮助,亚历山大——99%的人都不读笔记,但我很感谢一小部分人(像你一样)这么做!
如此强大和信息丰富!
很高兴你觉得有用,罗伯特!