醛和酮
水合物,半缩醛和缩醛
最后更新:2023年1月27日
水合化合物,半缩醛,还有缩醛树脂-它们由醛/酮形成,以及像P-A-D-P-E-A-D一样简单的机制
水合物,半缩醛和缩醛树脂都是除了反应氧基亲核试剂(水和醇)对醛而且酮
水合物而且半缩醛在平衡对应的醛和酮。
缩醛树脂都是经过处理形成的醛或酮与一个酒精在(无水)酸的存在下。
不像水合物和半缩醛,缩醛树脂是“锁定”的,是不与它们对应的平衡醛/酮.出于这个原因,缩醛树脂是醛/酮类的有效保护基团。
硫醇可以用来代替醇来制造thioacetals.硫缩醛最常见的反应是兰尼镍生成相应的烷烃。
目录
- 水合物的形成和机理
- 半缩醛的形成和机理
- 那么分子内半缩醛形成呢?
- 由半缩醛形成缩醛
- 从醛和酮形成缩醛-像PADPEAD一样简单
- 环缩醛
- 缩醛反应
- 缩醛作为保护基团
- 硫缩醛(及其反应)
- 总结
- 笔记
- 测试你自己!
- (高级)参考资料和进一步阅读
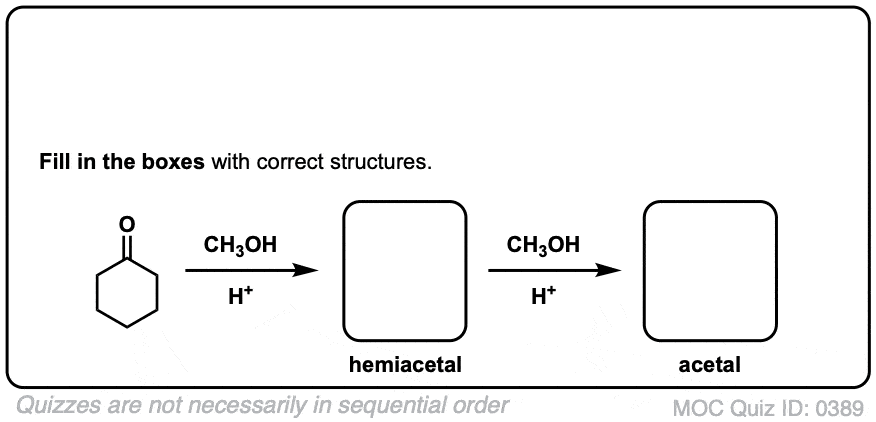
1.水合物
水合物,半缩醛,还有缩醛树脂.它们是什么,它们是如何形成的,它们的属性是什么,最重要的是——为什么你要关心?
让我们从最简单的水合物开始。它们碰巧是你最不应该关心的三个例子中的一个,但是,嘿,它们很有说服力!
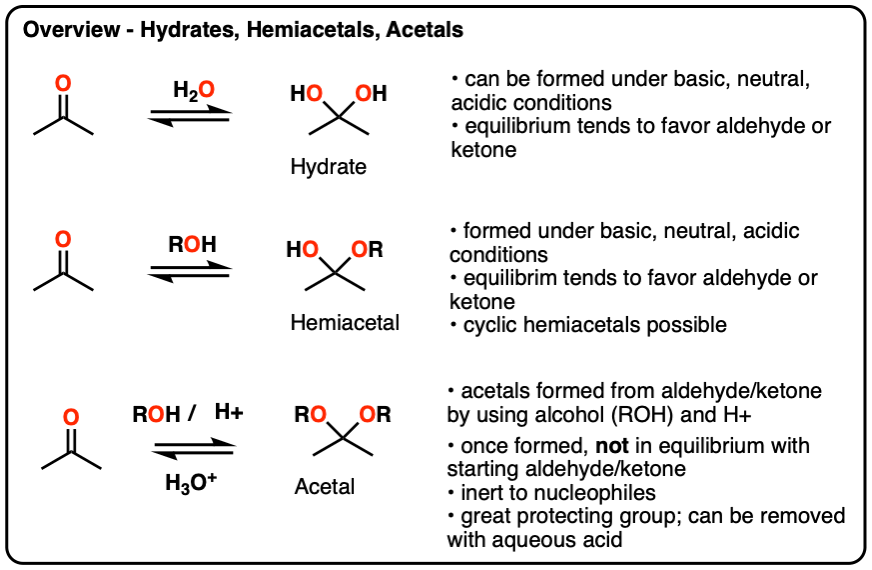
一个水合物醛或酮与水反应(H2O).水合物中含有一个碳单键连接两个OH(羟基)基团[C(OH)]2]。[注1- - - - - -水合物也被称为“宝石二醇”。
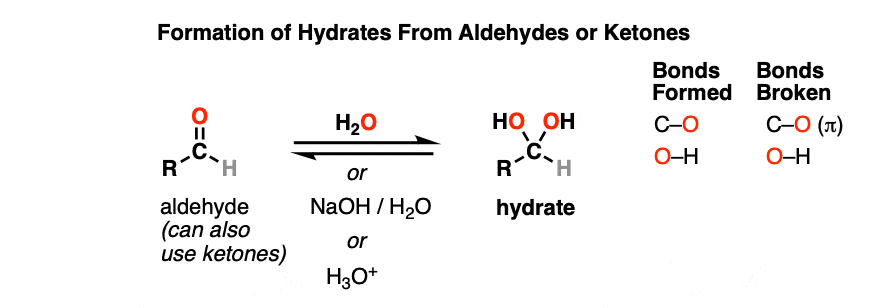
注意这个碳连着两个羟基。在反应中醛在水里,一个新的C-OH键形成了一个C-O键断裂了。另一种说法是这个网除了H2氧在C=O键上发生。
水合物形成通常是可逆的,在任何含有a的溶液中水合物开始时会有一个平衡醛或酮和水合物产品。一般均衡(但也不总是这样,注2)偏爱开头醛或酮.
水合物在溶液中相对稳定,但很难以纯形式分离出来。一次溶剂H2如果O被移除,平衡倾向于回到初始状态醛/酮.[注3- - - - - -这是经典的《勒夏特列》]
水合物可以在中性(H2O),碱性(NaOH/H2O)甚至酸性(H3.O +)条件。
最简单的机制水合物形成在下面基本条件(如NaOH / H2O).它由
1)添加的亲核试剂(HO-)到羰基碳[形成C-OH,破坏C-O (pi)]其次
2)氧质子化(O-H形式)。
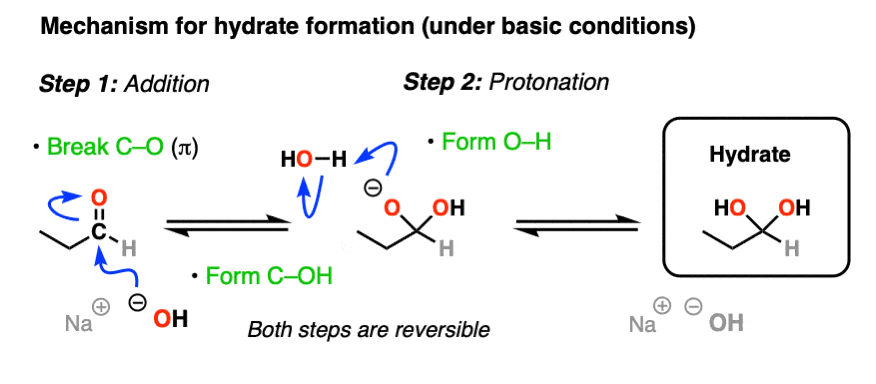
如果这个机制看起来很熟悉,那它应该很熟悉!精明的读者可能会注意到,这和经典一模一样“2步”机制,我们最近探索了醛/酮至少有7种其他显著的反应(还原、格氏加成、氰醇形成等)-除了紧随其后的是质子化作用.
经典的两步机制(悬停)或者点击链接.
在酸性条件下,由于我们必须考虑一个额外的质子转移步骤,这个机制要稍长一些。一种画法是从质子化开始的醛/酮氧与酸,然后2)加入H23) H的去质子化2O有温和的碱。
酸性水合物形成机理(hover)或者点击这个链接.
2.半缩醛
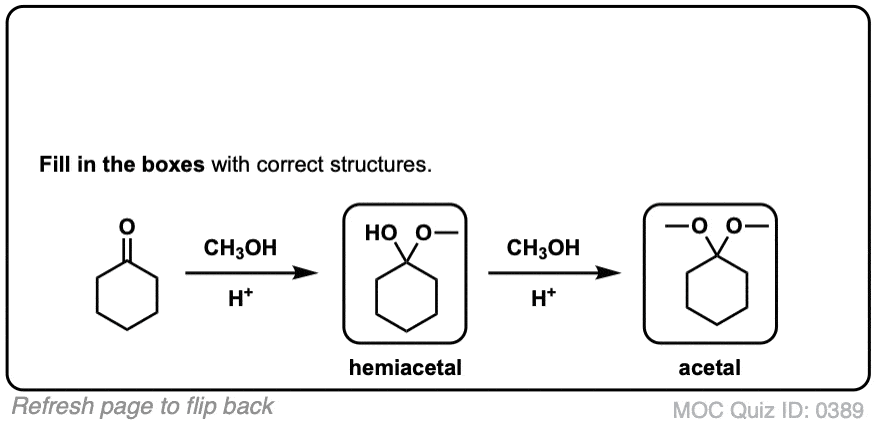
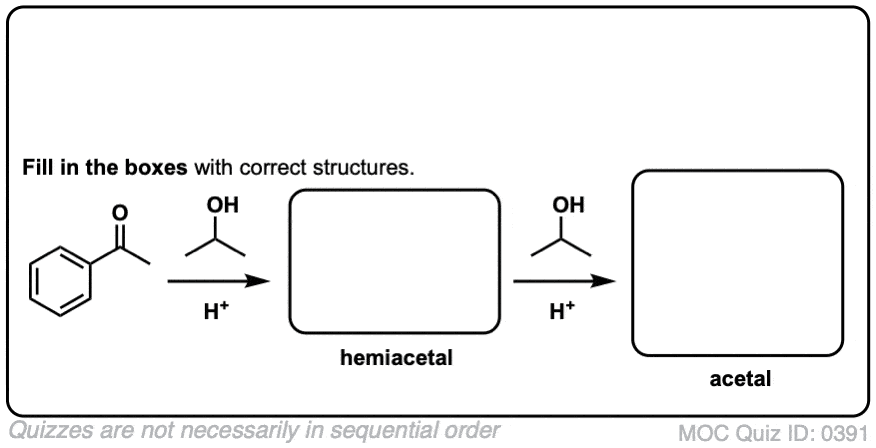
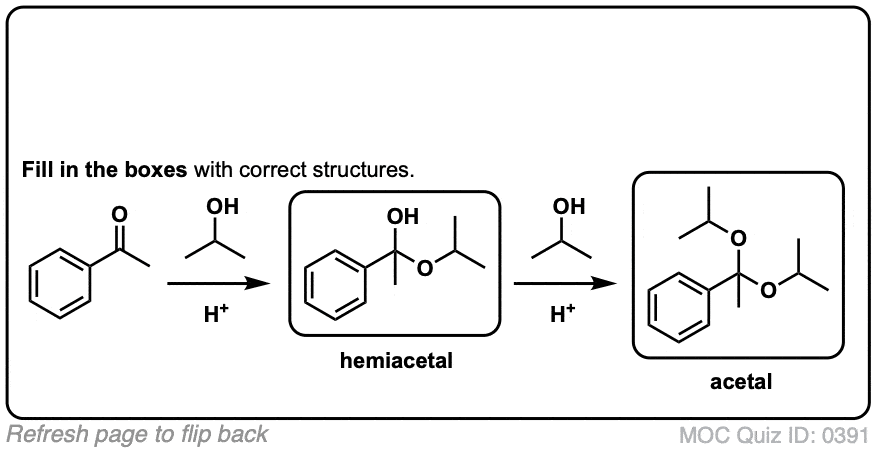
当醛或酮与醇反应时,它们就形成了半缩醛.一个半缩醛就像一个水合物只是其中一个羟基被OR取代了。
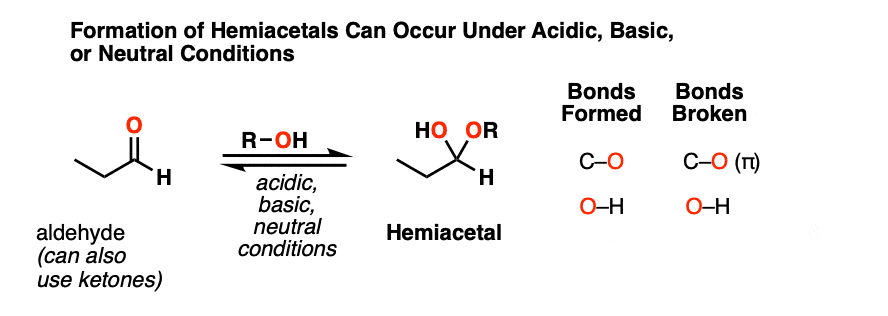
这是网络除了一个酒精(卢)穿过羰基组。一个碳氧键形成,一个碳氧键断裂,一个新的氧氧键形成。
与水合物的形成,半缩醛形成可以发生在碱性、中性或酸性条件下。
基本条件(RO- - - - - -, ROH]提供了这些官能团常见的经典“两步”加成-质子化机制(RO(-)加成后质子化)的另一个例子。
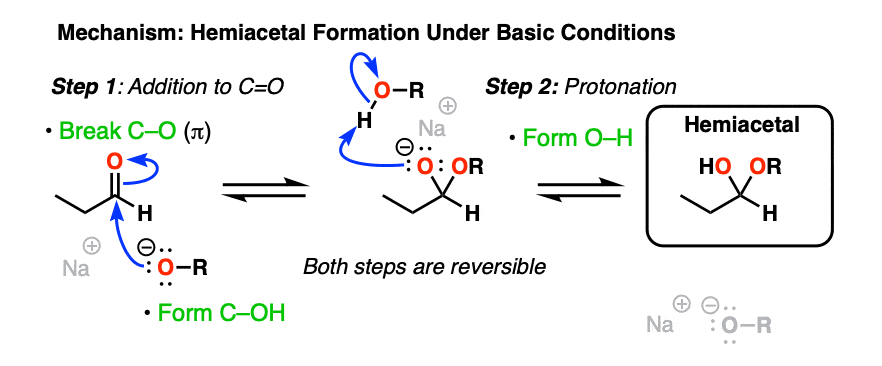
与水合物一样,中性或酸性条件下的机制需要额外的质子转移步骤。
在酸性条件下形成机理的一种方法是1)质子化醛/酮氧加酸,然后加中性酒精3)弱碱性氧的脱质子反应。
酸催化半缩醛形成机理(hover)或者点击链接.
平衡一般喜欢开始醛/酮.同样,隔离的纯粹无环半缩醛往往是困难的,因为溶剂的去除通常会导致损失酒精和开始的恢复醛/酮.另一方面,环半缩醛往往更稳定。[看到帖子:Ring-Chain互变现象]
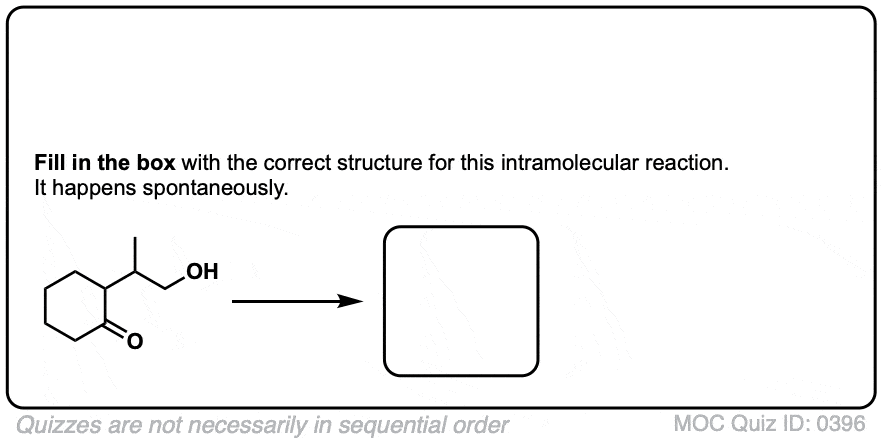
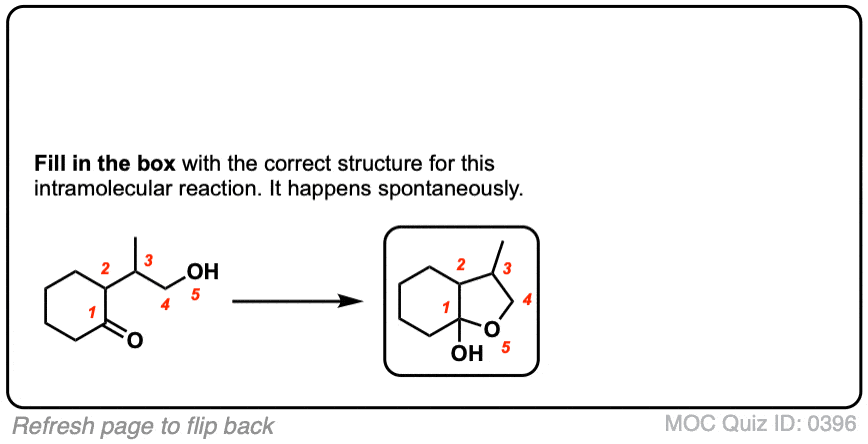
3.分子内半缩醛形成
如果一个酒精而且一个醛/酮存在于同一个分子上,总有可能它们会结合形成一个环半缩醛.
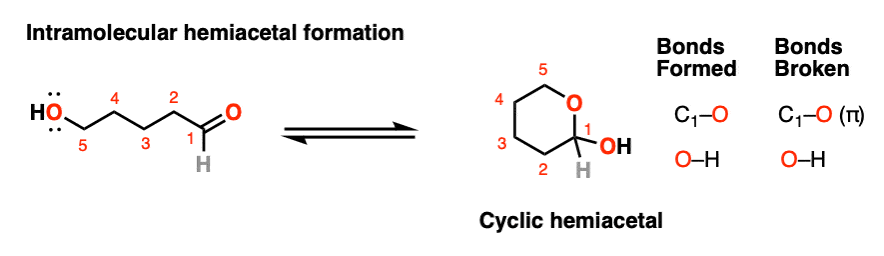
注意,这个反应与分子间反应基本相同。形成环的机理半缩醛和无环的没有区别吗缩醛.
我们仍然在形成碳氧键,破坏碳氧键,然后形成氧氧键。就是这样.唯一不同的是羟基和羰基都是通过碳链相连的。这需要一些时间来适应,但正如我经常告诉我的学生的那样,从概念上讲,这与将“亲核”皮带扣销穿过“亲电”皮带缺口所产生的环没有什么不同。
分子内半缩醛形成机制(hover)或者点击链接.
如果它们能结合成一个5元或6元环(也就是说没有环应变)平衡通常倾向于循环形式。大多数简单碳水化合物主要以环半缩醛的形式存在。例如,在25°C的水中,葡萄糖溶液在任何给定时间含有不到1%的开链形式!同样地,果糖和核糖(以及许多其他糖)通常被画成环半缩醛。
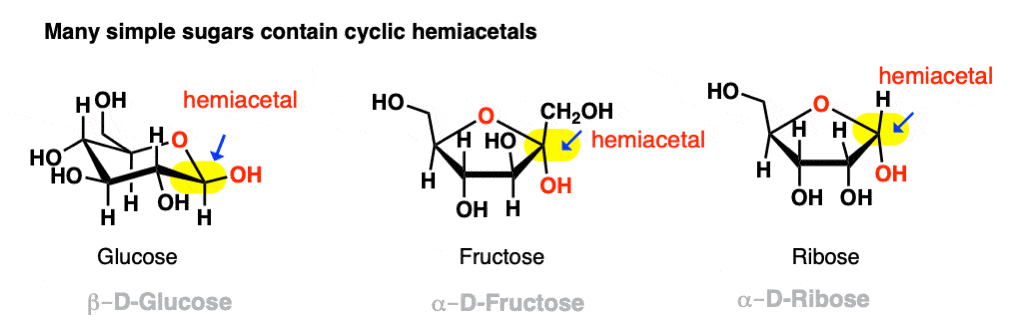
即使平衡强烈倾向于循环半缩醛(通常是5元环和6元环的情况)总会有一小部分的半缩醛以其与父元素的线性(“无循环”)形式醛/酮.这种行为有个好听的名字叫ring-chain互变现象.
如果你继续读第二册关于碳水化合物的章节,你会了解到这也是导致旋光改变在糖中,某些形式的葡萄糖溶液的旋光性可以随时间而改变。
可逆性半缩醛溶液中的形成也意味着,除了它们的外表,环半缩醛具有与母体相同的反应活性醛/酮因为这两种形式在溶液中迅速互换。
例如,如果一个循环半缩醛是用还原剂NaBH4它很快就会不可逆地还原为无环酒精.
环半缩醛还原(悬停)或者点击链接.
4.由半缩醛形成缩醛
单键连着两个OR基团的碳通常被称为an缩醛.(术语“ketal”也被用来描述缩醛树脂起源于酮,但我们还是用"缩醛“在这里)。[注意4]
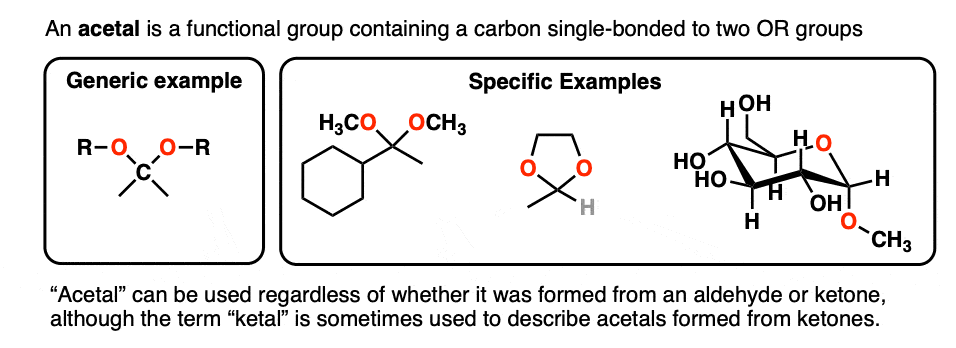
那么它们是如何制成的呢?
如果水合物和半缩醛是通过H的净加入而得到的2O和ROH分别穿过C-O π键,你可能会注意到一个两难的问题。
没有碳氧π键来加第二个对应的ROH !
如果你溶解a半缩醛在溶液中过量存在酒精,几乎没有缩醛会形成。
的半缩醛需要踢一下裤子!
现在如果我们加入(无水)酸就会把羟基质子化得到H2O +。[注5- - - - - -为什么“或”没有被质子化?正如我们之前多次看到的那样,共轭酸是一个更好的离去基.这就建立了第二重要的机制金属羰基合物,消除的离去基团形成一个新的C-O键其中O带正电荷。[注6].
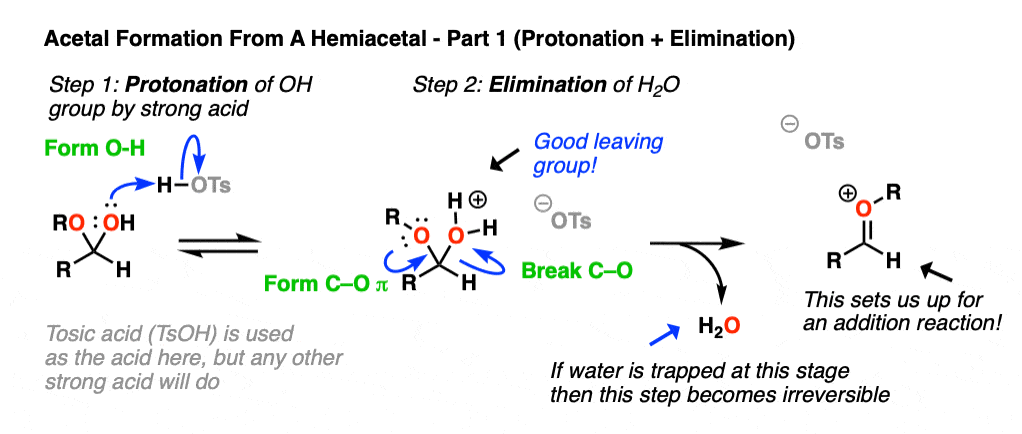
现在我们有一个碳氧键我们可以在上面加上第二个等量的ROH。
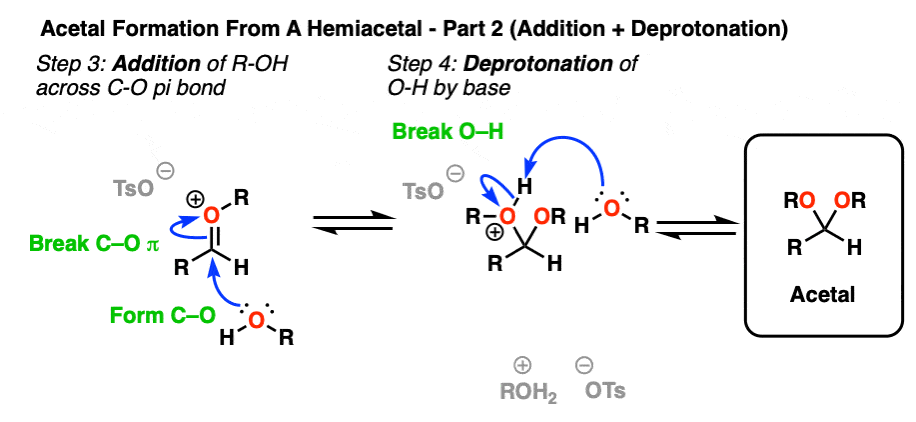
加入ROH,然后脱质子,就得到了中性缩醛.
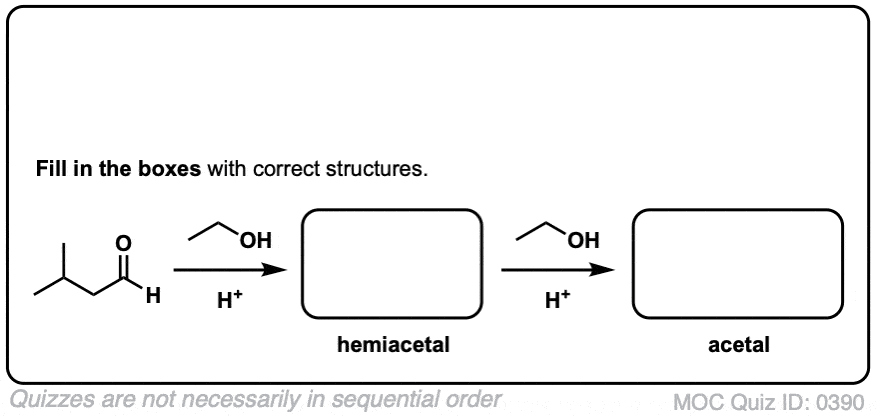
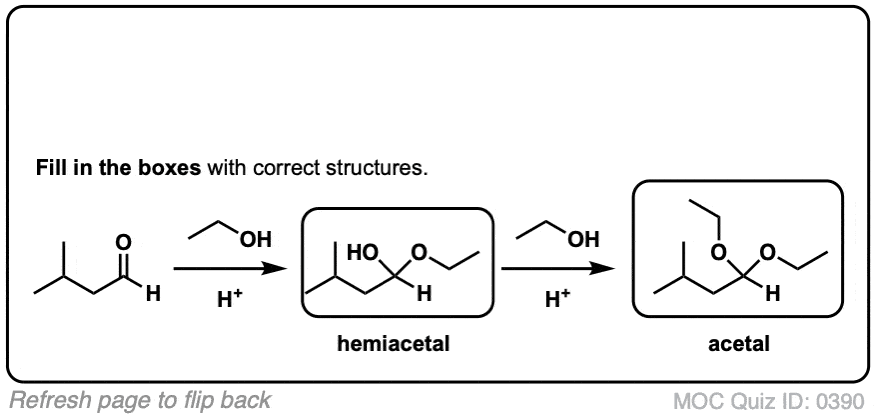
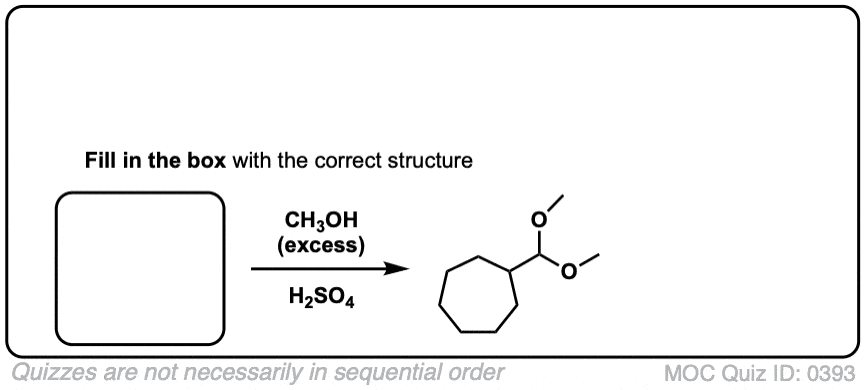
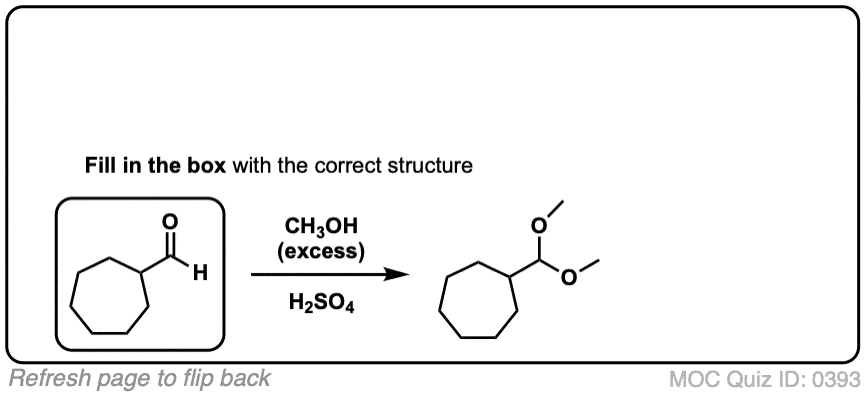
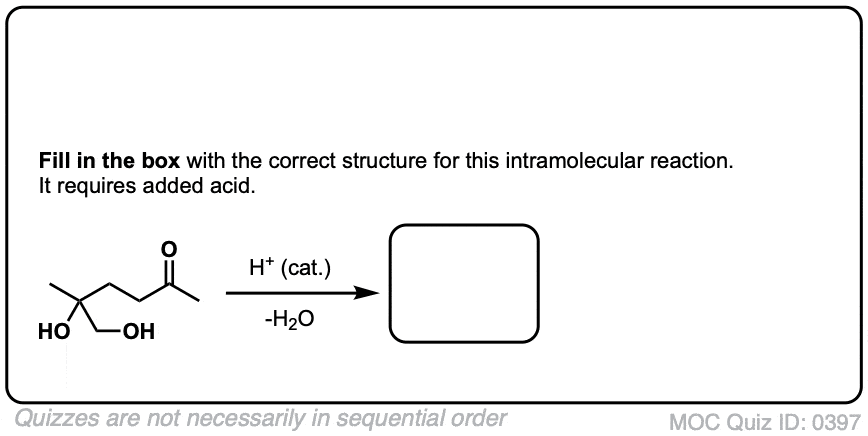
5.醛和酮缩醛的形成
知道怎么做很好缩醛树脂是由半缩醛形成的。但大多数时候,我们会看到醛和酮被转化的例子缩醛树脂,像这样。
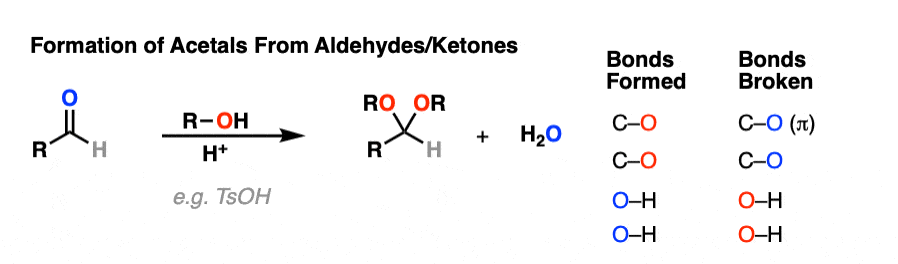
那么这是如何工作的呢?
我们已经讲过了这两个这些步骤!所以我们现在要做的就是把所有的东西放到一个扩展序列中。
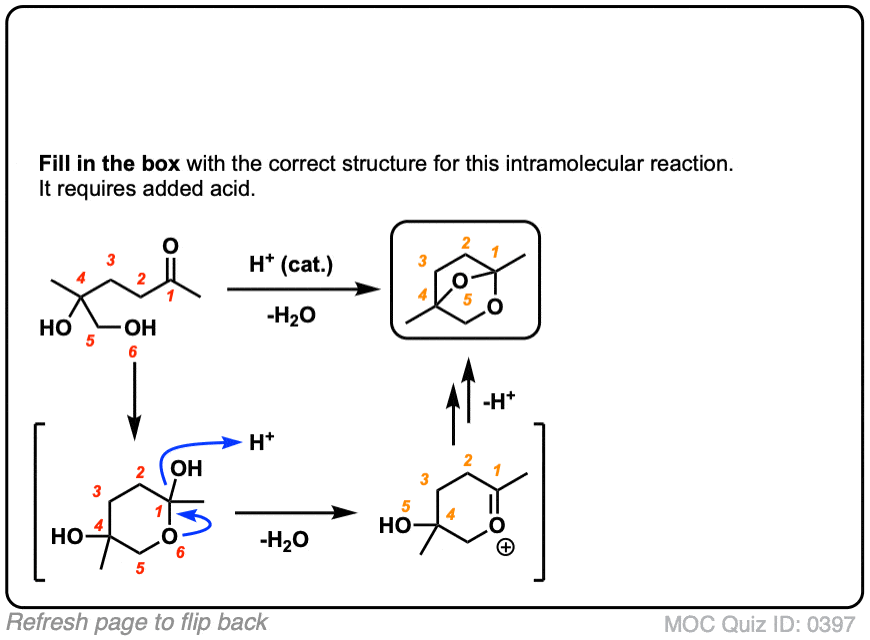
在化学中金属羰基合物(比如醛和酮)有很多机械步骤的重复。因此,您可能会发现将其中一些步骤缩写为P(质子化作用)D(去质子化)一个(添加),E因为这样可以帮助你们更容易地记住原理。
从缩醛到一个半缩醛是P a d.第一步是质子化作用的醛,然后是除了的酒精亲核试剂,去质子化把氧给中性半缩醛.
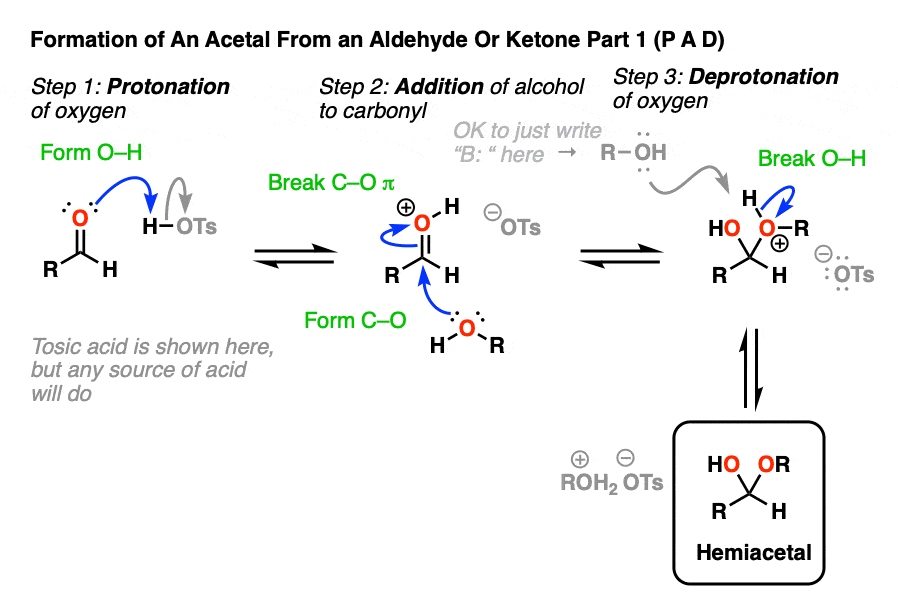
注意,我在这里画了有毒酸(TsOH)作为酸催化剂,但通常情况下,简单的H+在这里就足够了。
从半缩醛到缩醛是P e a d。羟基是质子化了的,然后是消除的水,除了的第二个等价物酒精,然后去质子化给予中性半缩醛.
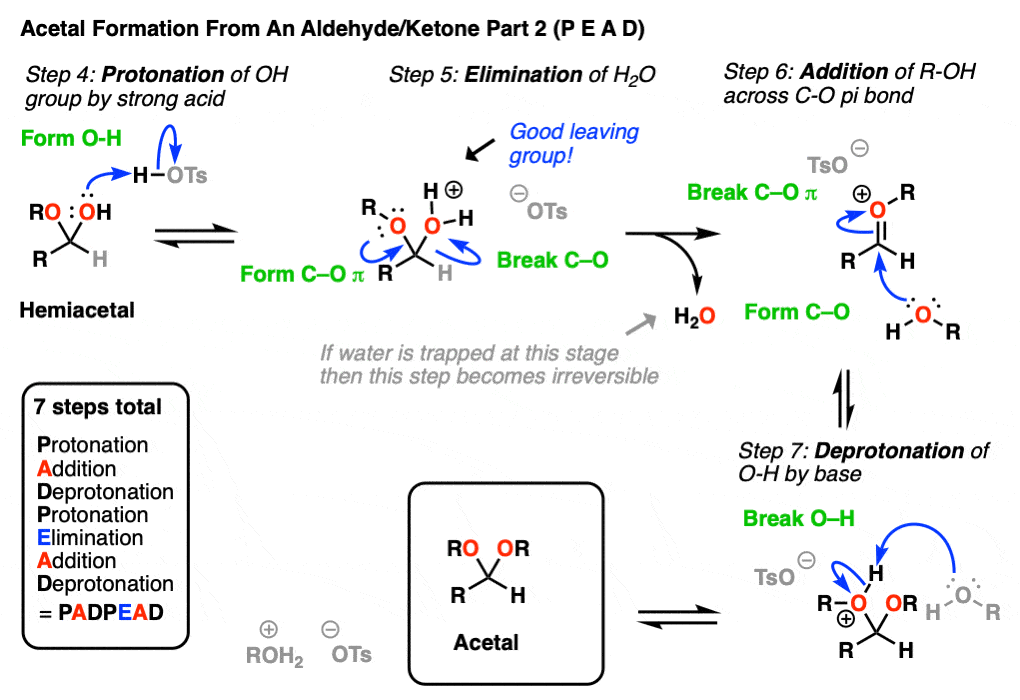
把所有东西放在一起,我们得到P a d P e a d,这是一个非常容易记住的助记法。
[一个注释-一个常用的速记术语Protonation -D质子化(或相反)基于非)是“质子转移”。在更高层次的课程中,省略质子-反质子步骤而只是波是很常见的质子转移的魔棒。因为,让我们面对现实吧,人生苦短。
有一件重要的事情需要注意缩醛形成过程的每一步都可能是可逆的。这给我们带来了一个小小的困境。如果我们想要缩醛例如,我们如何使平衡朝着期望的产物发展?
推动平衡前进的第一个考虑因素是使用大量过量的ROH,相对于H的摩尔当量2形成了。第二个考虑,可以与上述结合使用,是使用某种干燥剂(干燥剂),可以与任何H反应2O是形成的,或隔离H2O在一个Dean-Stark陷阱.
从有机合成,这里有一个制作二乙基的经典程序的链接缩醛乙醛。CaCl2用作干燥剂以及路易斯酸缩醛形成。
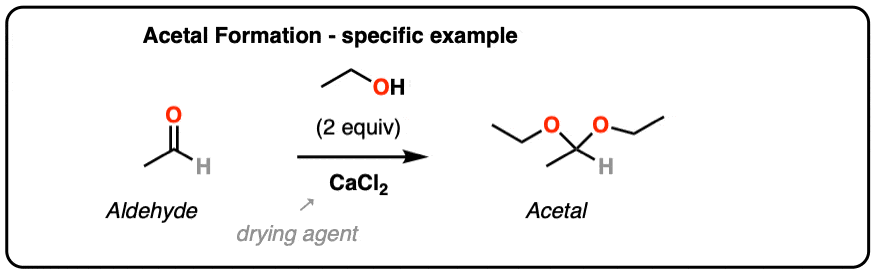
(H。阿德金斯和b。h。尼森,Org Syn Coll。第1页.]
6.环缩醛
还有一个问题缩醛编队是值得提及的,尤其是它似乎会出现在很多考试中。
到目前为止,在我们所有的例子中,我们都使用了“ROH”,假设R是一个短链烷基某种类型的群体(如CH3.哦,CH3.CH2哦)。
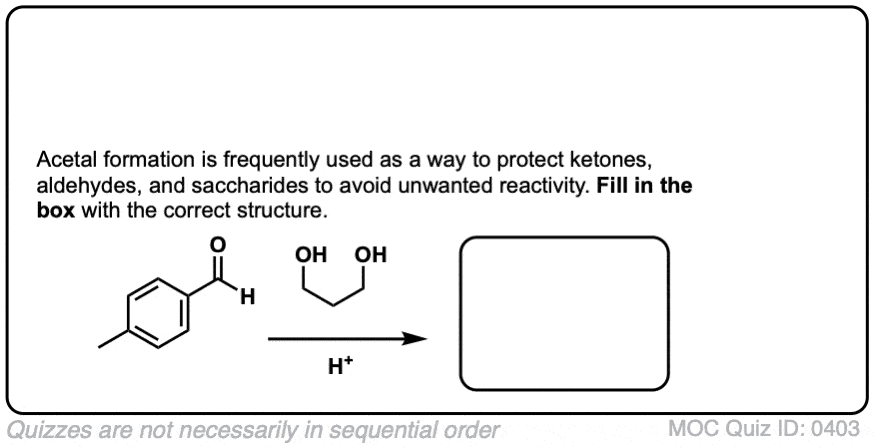
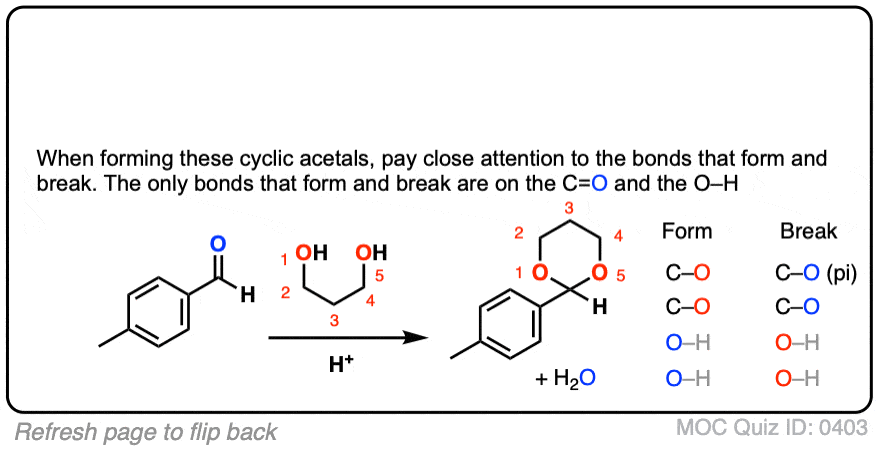
结果不是用两个短链的等价物酒精ROH,你可以用1个a的等量di-ol如乙二醇。这就导致了一个循环缩醛.[请注意7]
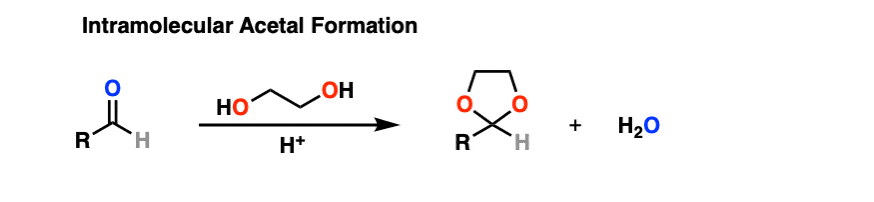
那么这是如何工作的呢?
这和分子间的情况没有什么不同。化学键的形成和断裂是一样的。机理是一样的。它仍然是P A D P E A D,也就是说,如果你需要自己看的话,这里有一个图像链接。
环缩醛(悬停)的形成机理或者点击链接.
顺便说一下,还有一种制造循环的可能性缩醛这是很好的考试题目素材。它需要一个含有a的分子酮还有两个羟基。加入酸可以让它卷曲成一个整齐的小蝴蝶结。看到注8获取详细信息。
7.缩醛反应
那么反应是怎样的呢缩醛树脂接受吗?事实证明,并不是很多。
我们之前看到半缩醛,和母体处于平衡状态醛/酮,与醛和酮的反应基本相同。
但事实并非如此缩醛树脂.
一旦形成,缩醛树脂被“锁定”在某个位置,与他们的父母不平衡醛/酮.在基本和中性条件下,它们像岩石一样坚固。NaBH4, LiAlH4,格氏试剂,有机锂,PCC你能想到的都有。缩醛树脂是坚不可摧的。
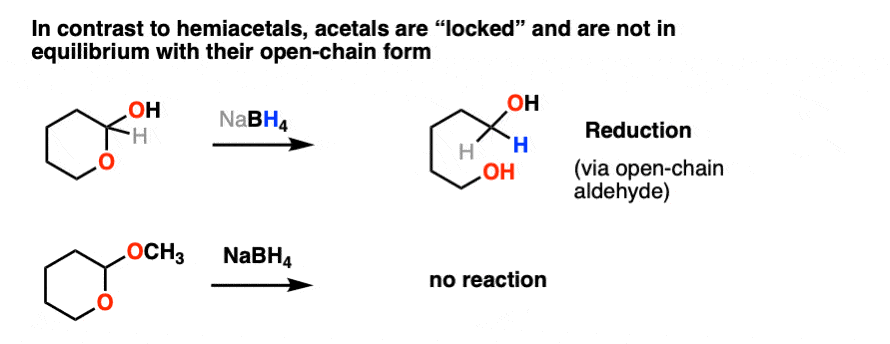
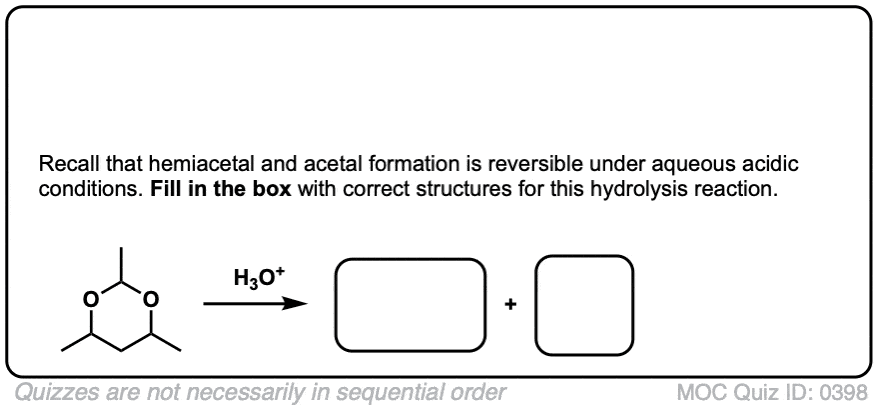
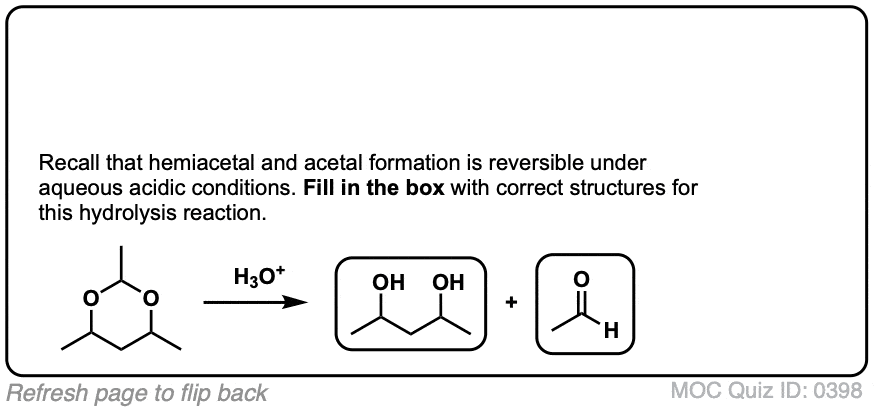
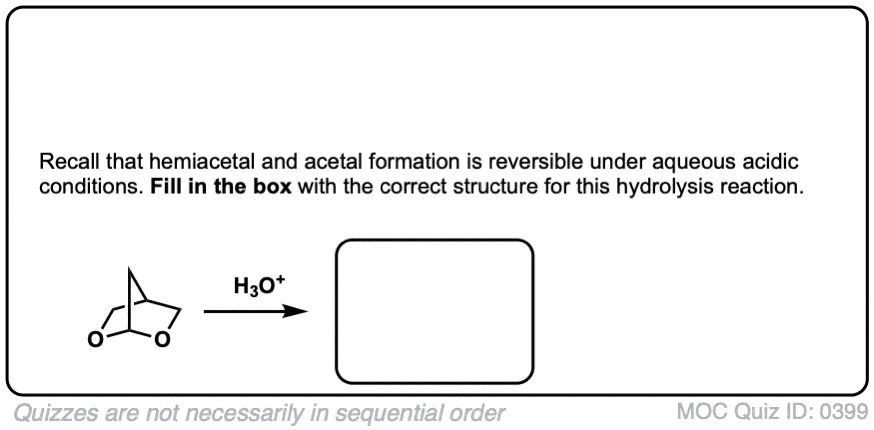
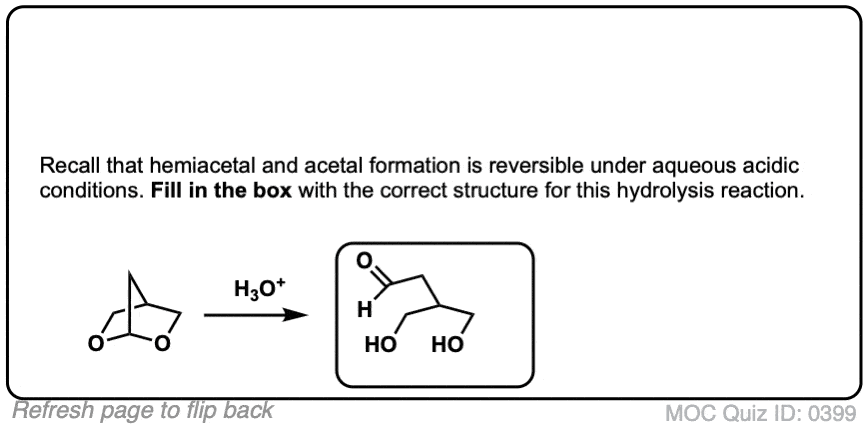
比如醚,另一个竞争者最无聊的官能团奖-缩醛树脂几乎只经历一种反应。当用酸性水溶液处理时,它们可以被水解回初始状态醛/酮.
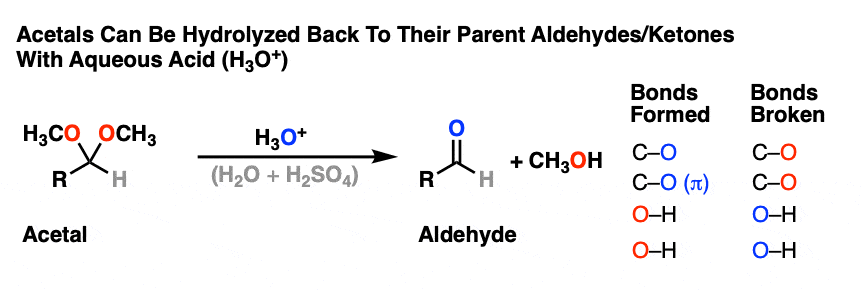
就是这样。你们已经看到了所有的反应缩醛树脂你需要看看。
那么这是如何工作的呢?让我来破坏悬念,告诉你它是某种组合P, D, E和A。
[事实上,如果你知道的话1)醛→缩醛是PADPEAD, 2) P和D是反反应,A和E也是反反应,那么你可以提前弄清楚它的机理是什么缩醛→醛是多少。注意9.]
好的。我们从一个缩醛然后加入酸水溶液。第一步是质子化作用.这给了我们好处离去基团由an取代的ROH消除形成一个新的碳氧键。碳氧键除了氧通过水转化为中性形式去质子化.然后,质子化作用另一个OR组的结果是ROH,经过消除给质子化醛.去质子化给了我们中性醛.
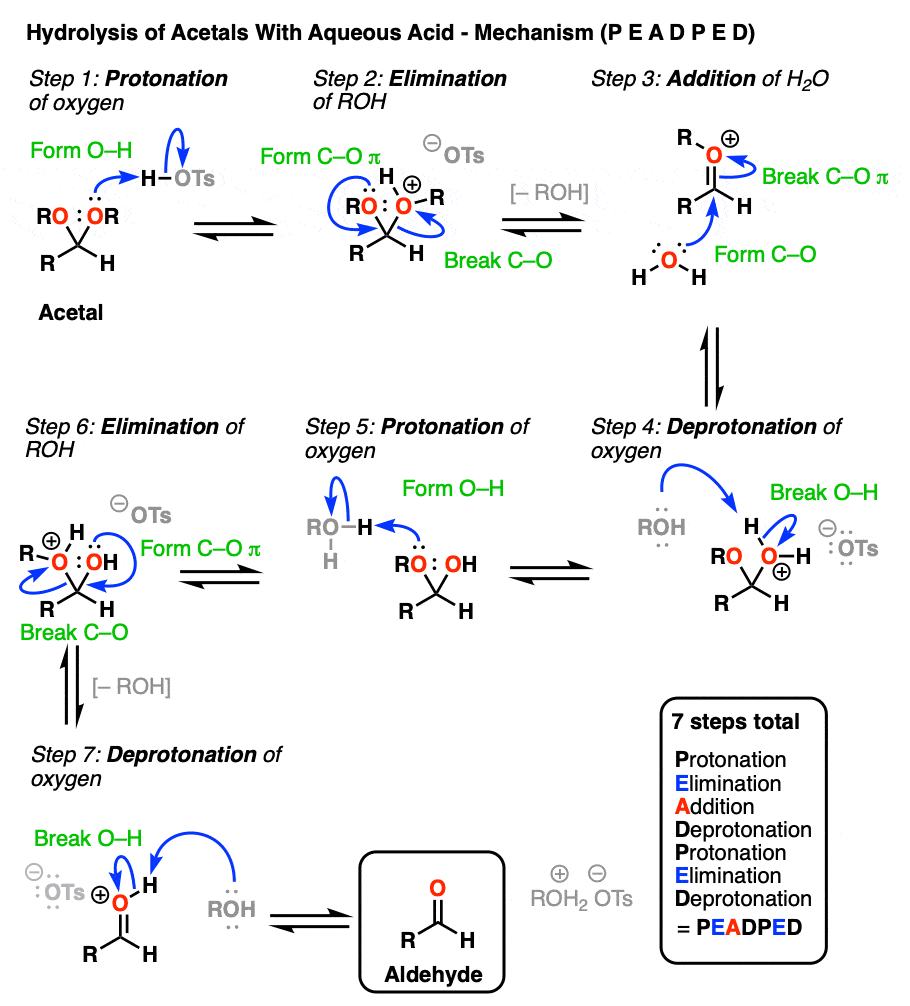
尽管一个醛在这里,它也适用于酮。
为了使反应完成,有必要使用大量过量的水,这将使平衡朝着最终产物发展。
8.缩醛作为保护基团
将活性官能团(如醇、醛和酮)转化为无活性官能团(如醇、醛和酮)有一个隐藏的好处醚或缩醛)然后再回来。
正如我们看到的醇它为我们提供了一种方法,当我们在分子的另一边摆弄另一个不同的官能团时,我们可以把化学上的“油漆布”涂在一个反应官能团上,因为我们知道它不会干扰我们的阴谋。
例如,试图在一个分子上生成格氏试剂醛或酮是不行的。格氏纤维一形成,就会和醛或酮,让我们在实验笔记本上写下一个大大的“BFM”。

然而,如果我们先保护的酮作为一个缩醛,然后把它转化成格氏试剂,我们可以尽情地格氏,而不用担心酮将被毁灭。完成格氏处理后,用酸水溶液处理得到的产物就很简单了,释放酮,毫发无损。
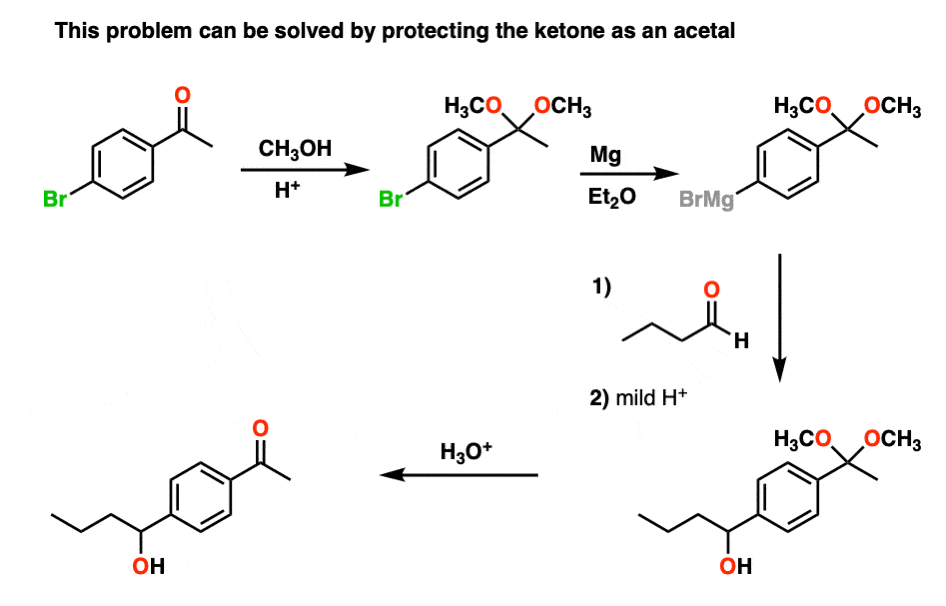
顺便说一下,你也可以反过来看。如果你合成一个二醇(例如,由一个的二羟基化烯烃),你可以保护二醇作为一个缩醛通过处理醛或酮.
9.硫缩醛及其反应
通常情况下,OH基团的很多反应都很好转化当你从元素周期表向下移动到SH时,只是味道变浓了很多。
通过治疗醛或酮与1,2-乙基二硫醇(相当于乙二醇的二硫醇)和像BF一样的刘易斯酸3.(当含硫时,普通的氢离子就不那么有效了)一个人可以做出thioacetal。
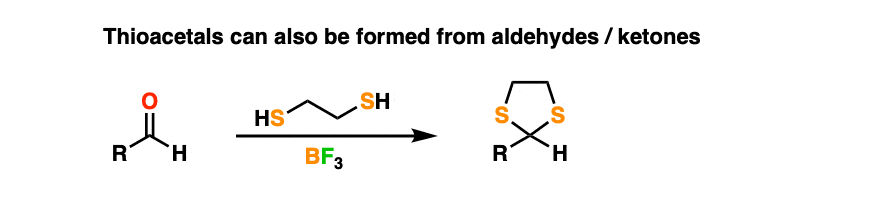
硫缩醛是非常有效的保护基团。然而,他们有一个有趣的特征,普通缩醛树脂所缺乏的。
通过处理硫缩醛兰尼镍,可以有效地“删除”硫缩醛,将C-S键替换为C-H键(兰尼镍是一种精细划分的镍铝合金,其中含有吸附的氢)。
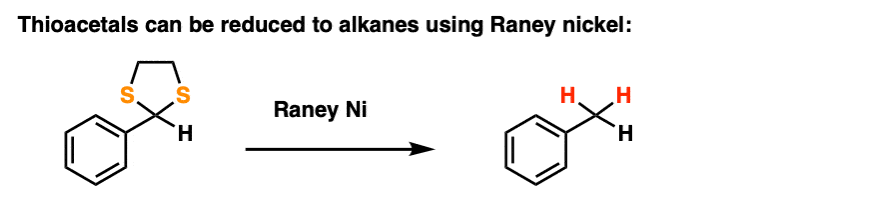
伴随着Wolff-Kishner和Clemmensen,这是一个摆脱麻烦的妙招羰基并将它们转化为烷烃,这是伟大的傅克反应的解决方案,顺便说一下。
10.结论
那么我们学到了什么呢?
- 水和醇可以与醛和酮结合形成水合物和半缩醛。这种平衡通常有利于醛/酮,但环半缩醛相当稳定。
- 不过,就反应性而言,环半缩醛和酮一样,因为它们处于平衡状态
- 治疗半缩醛用酸和酒精会把它转换成缩醛
- 对待一个醛或酮与一个酒精(或二醇)加上酸会转化成缩醛通过P a d P e a d。
- 缩醛树脂只经历一个重要的反应-水解与水溶液酸,发生通过P e a d P e d.
- 缩醛树脂醛/酮的保护基团有用吗
- 硫缩醛也很有用,但主要是因为它们可以转化为烷烃兰尼镍.
笔记
这篇文章在2022年2月被广泛重写,取代了一篇名为“On”的旧文章缩醛树脂和半缩醛”
注1 -水合物的另一种说法是偕的二醇”(宝石二醇)。偕的指的是两个基团连在同一个碳上。我们遇到了二卤化物将HCl和HBr加入炔烃例如。
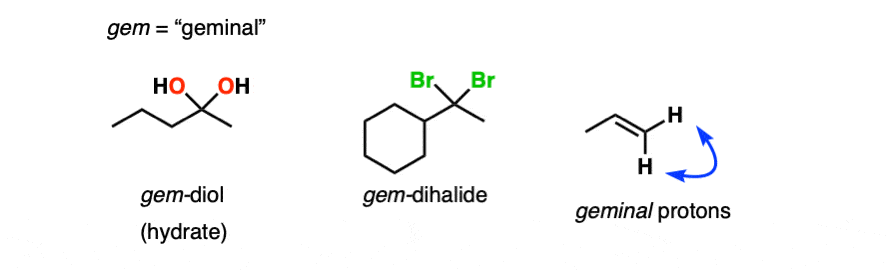
注2。吸电子基团稳定水合物的形式。的水合物氯醛[Cl3.例如,CCHO是无色固体。
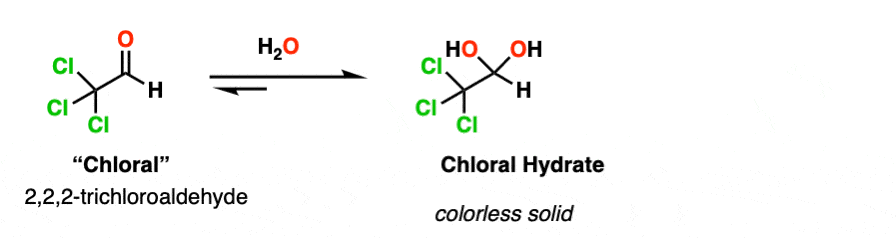
水合氯醛是最早的水合物被分离出来(1832年),早期被用作麻醉剂它可能是最有名的水合物最重要的是,在众多间谍和侦探电影中扮演着突出的角色,作为一个“蒙汗药或“致命药物”。
从活生生的白昼,1987
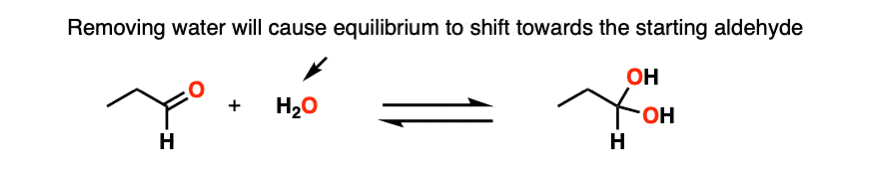
注3- - - - - -勒夏特列原理概略地说,改变一种化学物质的浓度会使平衡向与浓度变化相反的方向移动。如果我们降低CH的浓度3.在下面的反应中(即通过去除溶剂),反应将发生向左移动(产生更多的CH3.OH),从而失去半缩醛.
注4 -试图皈依羰基一组酯有数2R变成一个"缩醛通过使用ROH / H+制成RC(OR)3.不管用。然而,这些被称为“昊图公司-酯类的问题已经解决了其他方式(如氯仿的碱性水解)。
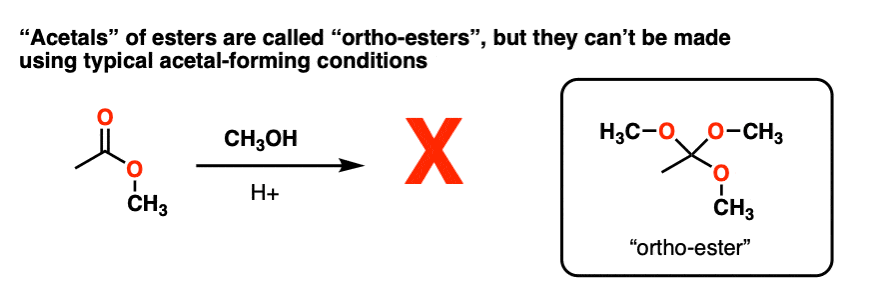
注5 -我们也可以把OR基团质子化,得到ROH(+),然后消去,得到一个质子化的羰基.
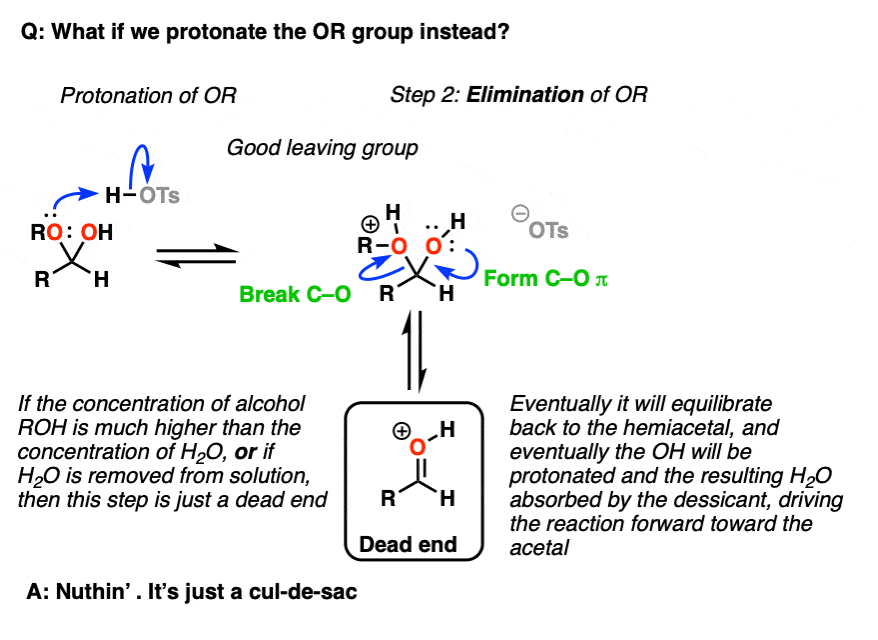
但现在要问,“接下来会发生什么?”如果ROH的浓度>>等于H的浓度2O(通常在这种情况下)然后是质子化羰基只是一条死胡同。当水被消除时,将其隔离将导致平衡朝着最终方向发展缩醛产品。
请注意6 -这个物种被称为“oxocarbenium离子”。
请注意7-你也可以用相反的方式来看待这个问题-醛/酮是二元醇的一个很好的保护基团!
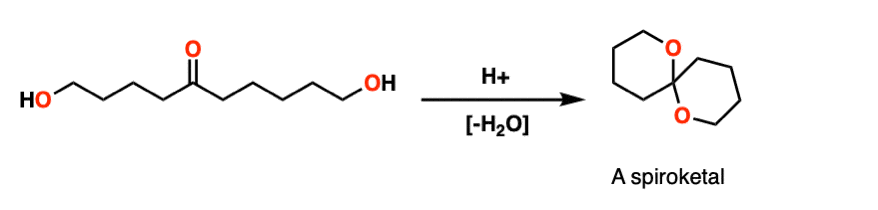
N投票选出8-这里有一个经典的例子。用酸处理这种分子会产生一种叫做“螺酮”的双环分子。
注意9-这是一种看待它的方式。从醛来缩醛-你应该买PADPEAD。现在跟踪从缩醛来醛(从右到左)。你应该被警告。
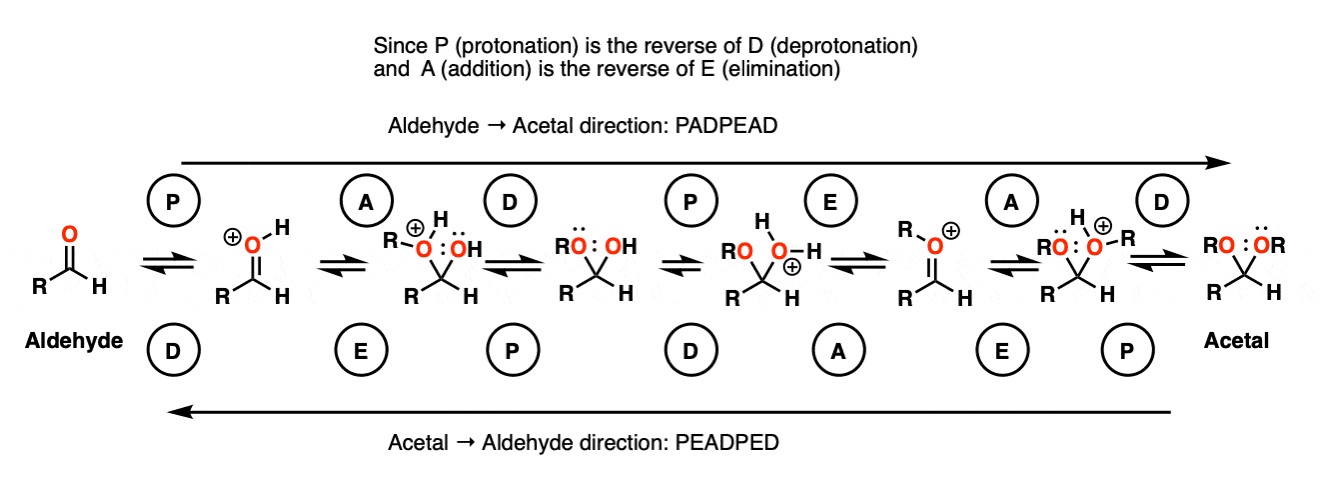
每个机制都有两个P步和两个D步(电荷没有净变化-它们相互抵消)
缩醛编队(从左到右)有两个增加步骤和一个消除步骤。
醛从右到左的阵型有一个加法步骤和两个消法步骤。
测试你自己!
 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
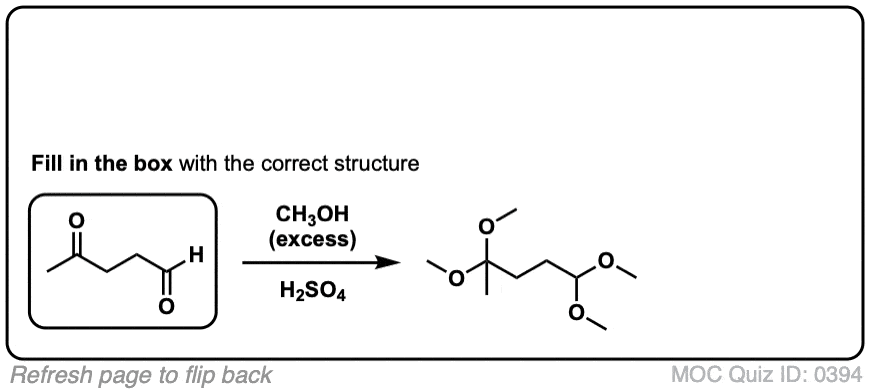
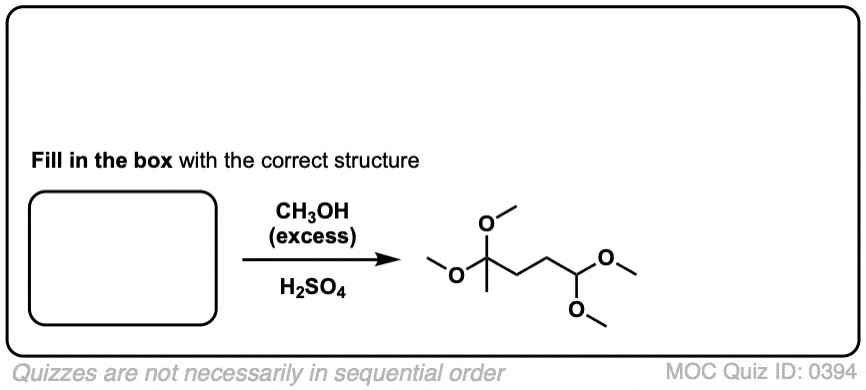 点击翻转
点击翻转
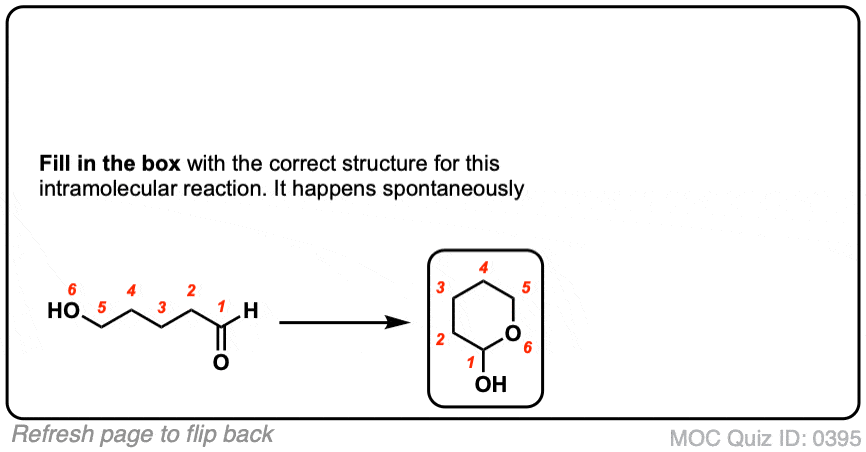
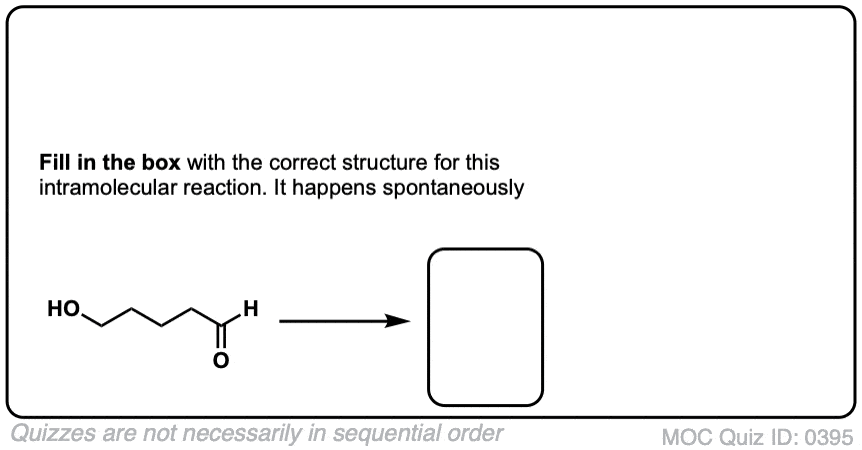 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
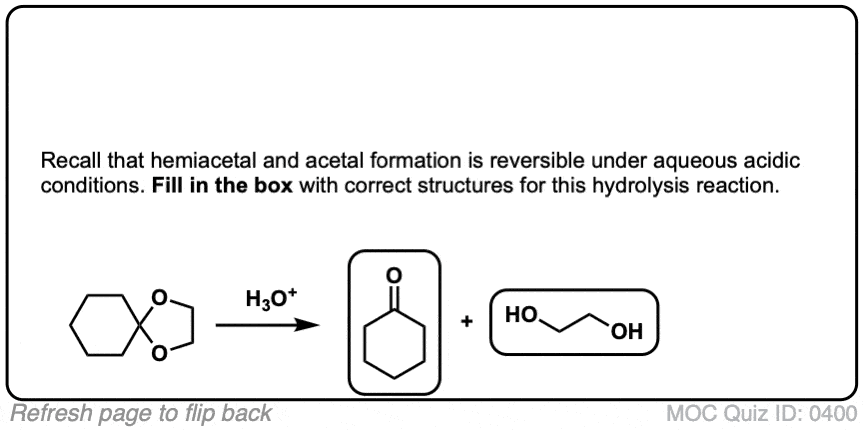
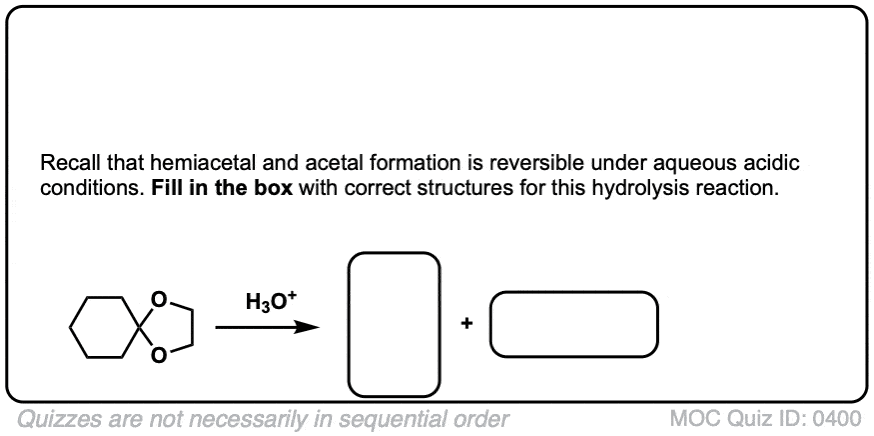 点击翻转
点击翻转
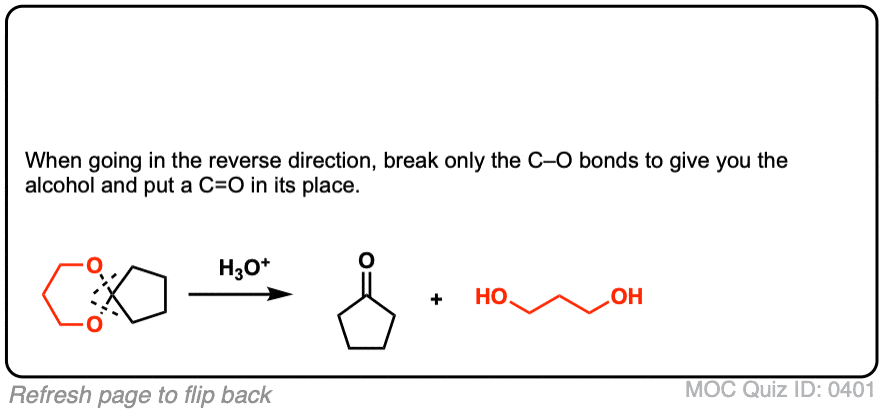
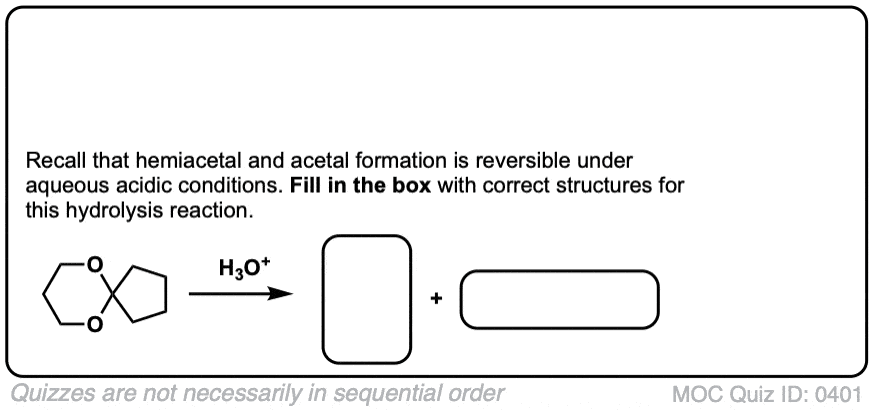 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
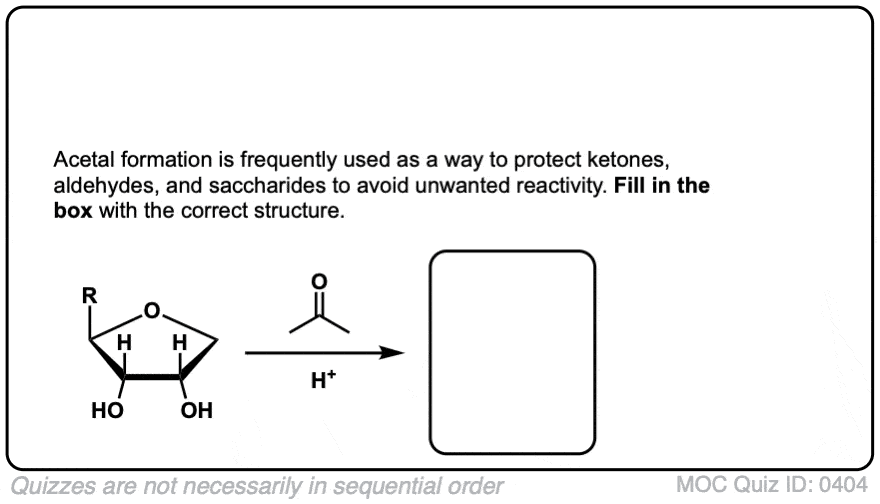 点击翻转
点击翻转
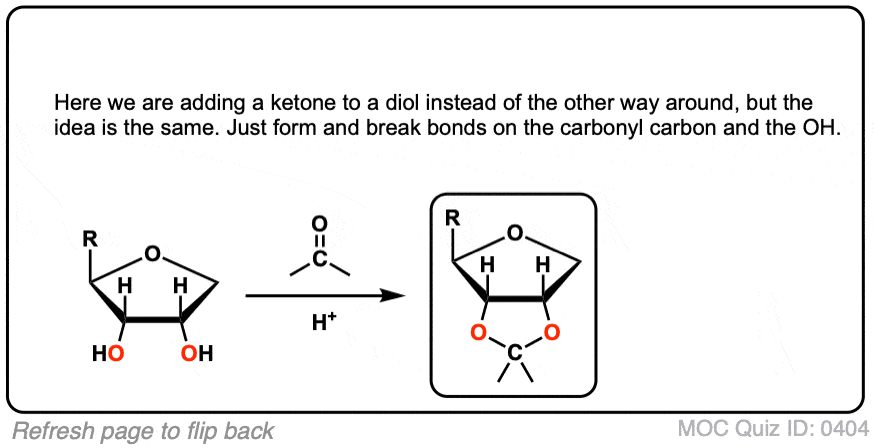
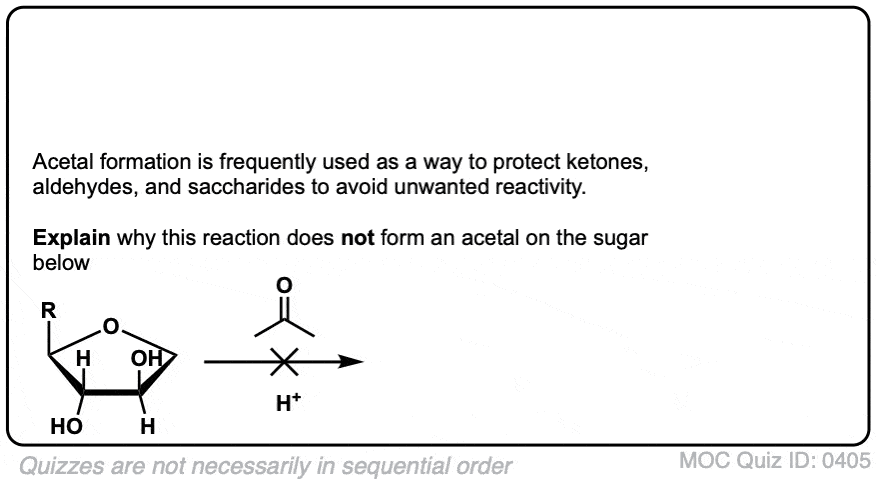 点击翻转
点击翻转
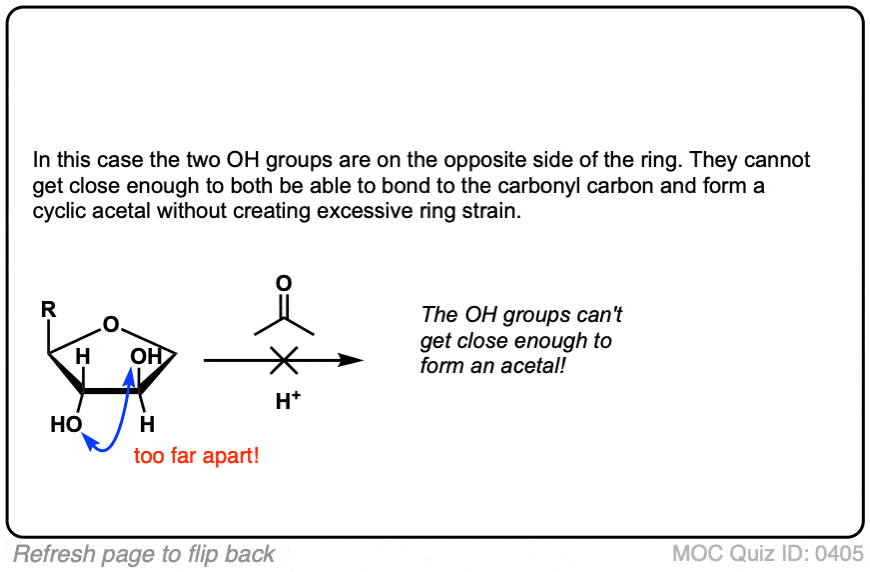
(高级)参考资料和进一步阅读
缩醛形成:
- 达斯特隆与醋酸
Emil Fischer和Georg Giebe
的误码率。1897,30.(3), 3053年
DOI:10.1002 / cber.189703003121
化学文献中关于缩醛化反应最早的参考文献之一,由传奇化学家埃米尔·费舍尔所著。 - -醛的直接缩醛化
罗伯特·唐斯·霍沃思和亚瑟·拉普沃斯
j .化学。Soc。反式.,1922,121, 76 - 85
DOI:10.1039 / CT9222100076
霍沃斯和拉普沃斯各自都是伟大的化学家,在这篇论文中,他们描述了缩醛树脂各种常见醛的(如肉桂醛、茴香醛、柠檬醛等)。这种化学反应在香料工业中具有重要意义——许多脂肪醛具有令人愉悦的气味,但在酸或碱中都不稳定。因此,开发能够保持醛的气味和结构的保护方法具有重要的商业意义。 - 的制备方法缩醛树脂从醇类或氧齐烷类和羰基化合物
弗兰斯·a·j·梅斯肯斯
合成1981;1981(7): 501 - 522
DOI:1055 / s - 1981 - 29507
回顾缩醛-形成反应与各种参考。 - 缩醛
霍默·阿德金斯和b·h·尼森
有机合成,第1卷,第1页(1941);第三卷,第1页(1923)
DOI:10.15227 / orgsyn.003.0001
有机合成中制备乙醛二乙基的早期程序缩醛.该试剂可作为一种方便,易于处理,不易挥发的来源原位乙醛。缩醛水解: - 水解机理及催化作用缩醛树脂,酮,和昊图公司酯类
g。h。科德斯和h。g。布尔
化学评论1974年,74(5), 581 - 603
DOI:10.1021 / cr60291a004
回顾了到目前为止所做的关于确定机理的工作缩醛水解。一些研究指出碳正离子的形成是决定速率的步骤。 - 酸催化水解缩醛和Chloroacetal
莫里斯·m·克雷沃伊和小罗伯特·w·塔夫脱。
美国化学学会杂志1955年,77(11), 3146 - 3148
DOI:1021 / ja01616a075
本文论证了水解速率与Hammett酸度(Ho)为溶剂的一般酸度函数。这进一步支持了碳正离子形成是速率决定步骤的假设。 - 苯乙酮二甲基酮水解中氧碳离子中间体的捕获
p·r·杨和w·p·詹克斯
美国化学学会杂志1977年,99(25), 8238 - 8248
DOI:10.1021 / ja00467a019
在本文中,氧碳离子形成过程中缩醛水解被亚硫酸氢盐离子捕获,证实它确实是反应中的中间产物。 - 的影响烷基苯甲醛酸水解机理的基团大小研究缩醛树脂
alexander T. N. Belarmino, Sandro Froehner, Dino Zanette, João P. S. Farah, Clifford A. Bunton, Laurence S. Romsted
有机化学杂志2003年,68(3), 706 - 717
DOI:1021 / jo0202987
本文提出了水解机理由特定酸(H+)到一般酸催化取决于缩醛结构。 - 一般酸催化水解1,3-二氧唑烷和1,3-恶硫唑烷。水解缩醛树脂对二甲氨基苯甲醛的硫缩醛
Thomas H. Fife和R. Natarajan
美国化学学会杂志1986年,108(9), 2425 - 2430
DOI:1021 / ja00269a048 - 一般酸催化缩醛水解。水解缩醛树脂还有酮独联体- - -反式1, 2-cyclohexanediol。速率决定步骤和机制随pH值的变化
Thomas H. Fife和R. Natarajan
美国化学学会杂志1986年,108(25), 8050 - 8056
DOI:10.1021 / ja00285a028
这两篇论文不出所料地证明了缩醛水解随pH值而变化。 - 一般的酸催化缩醛、酮和昊图公司酯水解
托马斯·法夫
化学研究纪要1972年,5(8), 264 - 272
DOI:1021 / ar50056a002
法夫教授对他的工作有关的机制的叙述缩醛水解。 - 糖苷水解的分子内催化作用缩醛树脂
卡彭,M.C.史密斯等人。
j .化学。Soc。B。1969, 1038 - 1047
DOI:10.1039 / J29690001038
一个例子缩醛由于分子内质子转移,水解反应速率大大加快。
我想知道你是否可以发一些东西来解释一下如何观察一个,并判断它是半缩醛还是缩醛。我知道半碳上有一个醇和一个醚连着同一个碳。但如果能看到每一部分都标出来并向我们解释就好了。谢谢这个帖子,太棒了!
我在组成缩醛官能团和半缩醛官能团的相关原子周围画了一个方框。这真的有用吗,还是会让事情看起来更糟?
问个小问题,在葡萄糖的结构中,我从没见过3号和4号碳上的羟基是这样画的。看起来你已经画出了糖糖。我遗漏了什么吗?欢呼。
固定的。谢谢!
伟大的解释。这所大学失去了一位伟大的教授
只是想知道,溶液的pH值会影响葡萄糖半缩醛的平衡吗?
是的,它使OH变成O- O-是比OH更好的亲核试剂(也更差的离去基)而且它会增加环闭产物的数量。
这种合成缩醛的过程对酯无效,对吗?如果不是,为什么不是?
有一个内酯和一个酮,我试着用LiAlH4水解它,然后用PBr3和Mg把它封闭成一个全碳环,但是是酮。似乎如果我加入缩醛或酸酯就会打开?
不,对酯不起作用。最终会发生酯交换反应。有邻酯,但它们不是由酯形成的。https://en.wikipedia.org/wiki/Orthoester
你能包括半缩醛在基本条件下的形成吗?这不是唯一可行的非中性途径吗?
“用NaBH4这样的还原剂处理葡萄糖最终会完全将其还原为酒精,因此它被归类为还原糖。”
我认为这是不对的。事实上,它可以被氧化成羧酸,并在这个过程中还原另一种化合物,这使它成为还原糖。
你说得对。我的错误。//m.deriinvest.com/2017/09/12/reducing-sugars/
它只与碳水化合物形成缩醛,不加入醇基。
非常感谢!
帮了大忙!
Tem como formar um acetal apenas como carboidrato, sem a adição de um grupo álcool。
Desde já, agradeço!
Ajudou muito !
更poler keton和ketal是什么
酮有更大的偶极矩。
谢谢,这是很好的简化和惊人的
您好,先生,非常感谢您的精彩笔记。
我的疑问是-在第3个问题的第3位我们如何决定应该先用哪个OH,为什么不先用另一个OH ?
谢谢你!
谷歌绝对应该把这个页面排在“chem”前面。自由教科书"为搜索"缩醛与半缩醛形成"的人准备的"
我自动跳过了化学。自由,来这里....本页是化学所有东西的来源。谢谢大家。
谢谢你,埃里克。家教怎么样?
我不太明白质子化是如何使羰基在酸性条件下更亲电的。你能详细解释一下这部分吗?
你能解释一下缩醛或半缩醛是如何在酸性介质中转化为醛的吗?
丙酮与苯酚在硫酸存在下发生亲电加成而不形成缩醛的原因是什么?
强酸可能使苯酚质子化。不要以为苯酚会形成缩醛。
如果羰基化合物上有一个羟基然后在酸性条件下加入酒精,哪个羟基先攻击会有区别吗?换句话说,是先发生分子间反应还是分子内反应?
谢谢你!
需要看具体的例子,但一般来说,如果一个5元或6元环可以形成,你可以假设它会先发生。
例如,像葡萄糖这样的糖在C-1上有一个醛,在其他5个碳上有一个醇,而且它们大部分时间(99%)都是环半缩醛。在这里看到的:
//m.deriinvest.com/2017/07/13/pyranoses-and-furanoses-ring-chain-tautomerism-in-sugars/
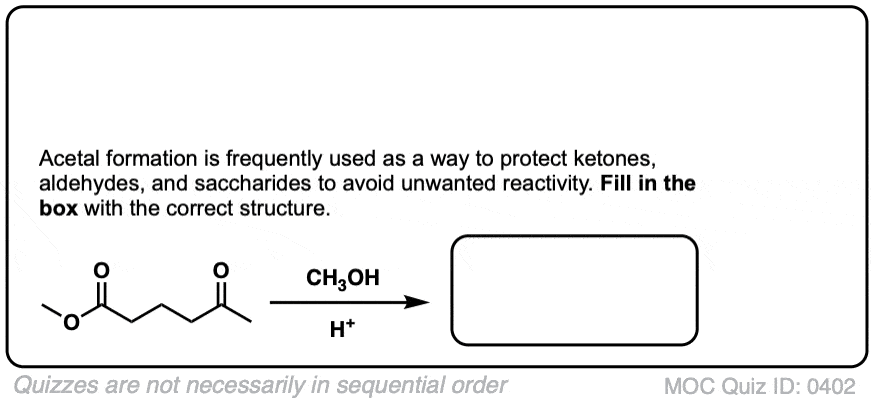
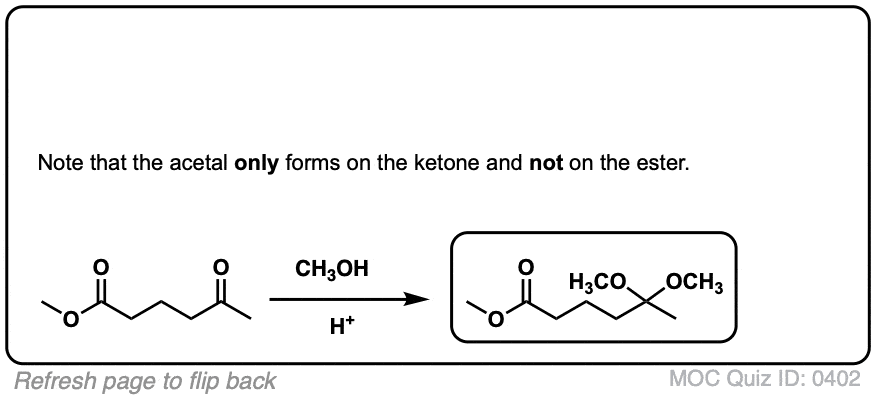
问题- 0402可以这样吗
首先氧原子攻击介质中的H+,以醇的形式留下sp2杂化碳正离子。
然后乙烷-1,2-二醇攻击碳,导致氧得到双键上的电子变成负电,然后由于介质中的H+形成一个-OH基团
这个碳仍然带正电荷然后受到另一个羰基氧原子的分子内攻击
这就得到了一个生成物一个生成物有6个原子的异质环(因为它有一个氧原子)这个环有一个半缩醛基团。
如果你能告诉我哪里错了,指出我的错误,我将非常感激
谢谢你! !
附注:我假设在我的溶液中,反应机制中有太多的中间产物,这可能会导致反应不那么有利或产生阻碍
如果有更多,请让我知道
半缩醛和缩醛能在碱性介质中水解吗?
我认为螺旋体酮(注8)是由酮二醇形成的,酮二醇应该少一个CH2(总共9个碳)。
苯酚和甲醛在基本条件下能合成半缩醛吗?
是的,酚氧可以加入甲醛,形成半乙酰类结构。