家/更好的离去基团的共轭酸
置换反应
更好的离去基团的共轭酸
最后更新:2022年12月5日|
添加酸增加离去基团能力
当然,是一回事识别卤素(氯、溴和我)为高离去基团能力,以及甲苯磺酸盐(TsO)和甲磺酸(TsO)但是如果你有一个官能团如HO - ?你如何让党氢氧根离开?继续读下去!
表的内容
- 薄弱的基础是好离开团体,氢氧根离子不是一个好的离去基团(-哦)
- 添加酸转换强碱的离去基团(-哦)弱得多基地H2O
- 共轭酸总是更好的离去基团
- 卤素可以制成更好离开团体加入路易斯酸如银离子(Ag) +)
- 笔记
1。薄弱的基础是好离开团体,氢氧根离子不是一个好的离去基团(-哦)
的一个关键因素,决定是否一个亲核的取代反应会发生与否的身份吗离去基团。之前,我们已经看到,好离开组织软弱基地(看到帖子:是什么让一个好的离去基团?)
这意味着,如果你看到一个卤素(氯、溴或I)或甲苯磺酸盐(OTs)或甲磺酸(OMs)分子,这些都是好的候选人离开团体,Cl(-)以来,Br(-),我(-),TsO(-),美索(-)都是弱碱性。
问题就在这里。如果我们对一个分子官能团,我们想参与一个取代反应,但它不是一个好离去基团上面列出的吗?例如,下面列出的反应不工作,因为离去基团(HO)是一种强碱,因此一个贫穷离去基团。
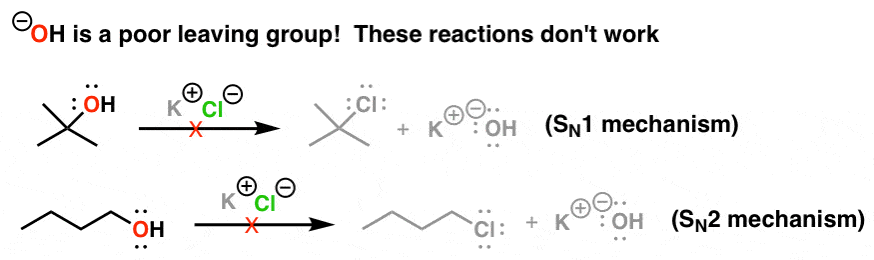
2。添加酸转换强碱的离去基团(-哦)弱得多基地H2O
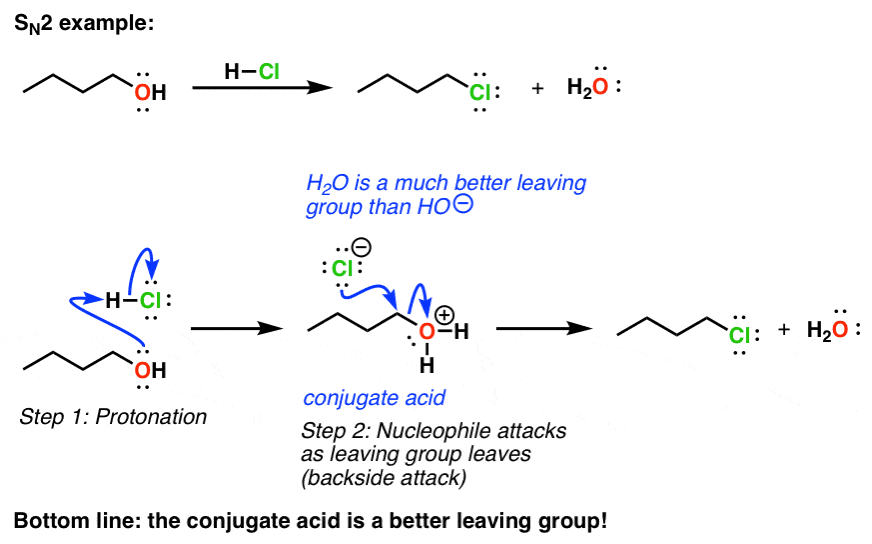
我们能做什么来参与哦(和其他类似的组织),这样他们可以参与置换反应?我们需要我们的离去基团是一个较弱的基础。我们如何使它成为一个较弱的基础?通过删除一些电子密度。这是最好的方法把它与酸。这将使共轭酸我们的离去基团,这将是一个较弱的基础。然后这些反应进行得很好。
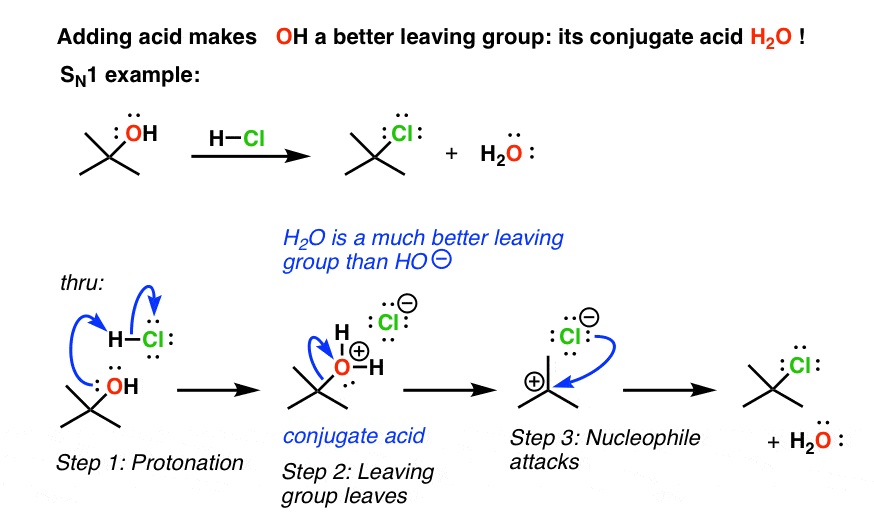
这是一个年代N2的例子:
3所示。共轭酸总是更好的离去基团
把一些数字,如果你看看pK一个表,你会发现pK一个H2大约14 O(水)(看到帖子:如何用pK吗一个表)。它的共轭碱HO (-)。当我们添加酸、水成为H3O (+), pK一个-1.7。这是一个更为强大的酸,换句话说,因此它的共轭碱(水,H2O)弱得多。换句话说,通过添加酸,我们使它更好离去基团。
这是一个普遍现象,顺便说一下,共轭酸永远是一个更好的吗离去基团。
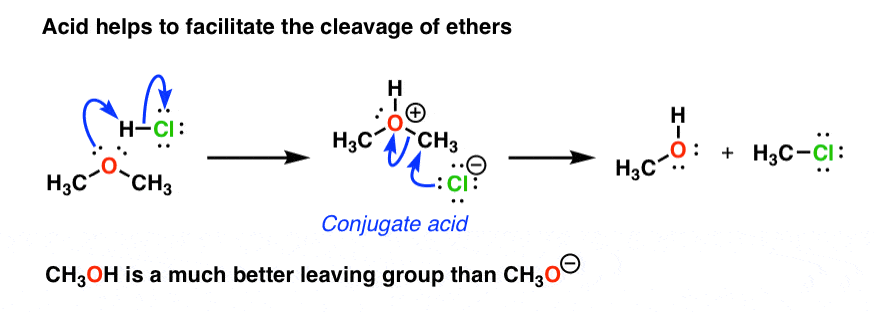
它不仅适用于哦,但是其他的官能团。例如,醚(R-O-R)你会碰到一些最不起化学反应的物种。然而,如果您添加一个非常强烈的酸的醚,你可以把它给一个开放酒精和一个烷基卤素灯:
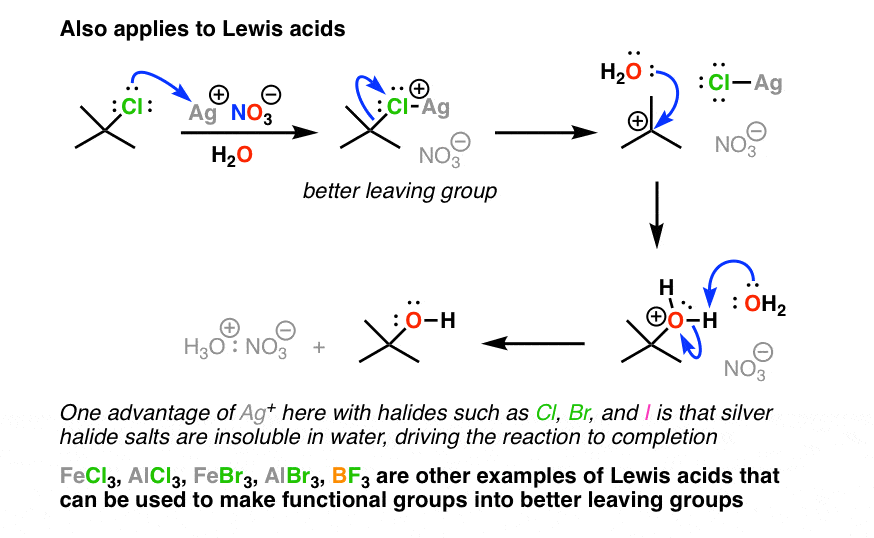
4所示。卤素可以制成更好离开团体加入路易斯酸如银离子(Ag) +)
我们可以利用这一点卤素更好的离开组织。卤素不与H +反应和醇类和醚类一样容易,但他们做与某些反应路易斯酸(记住——路易斯酸接受孤对]。路易斯酸,得到了很多的关注和卤化物Ag) +(银离子)。
你可能会认为这是AgNO3或AgBF4(抗衡离子没有3(-)或男朋友4(-)只是一个旁观者)。当Ag) +结合氯等卤素,由此产生的物种R-Cl-Ag(+)有一个相当弱C-Cl债券,这意味着它可以更好地参与置换反应。与二级或三级烷基卤化物,结果通常是形成碳正离子。
一种好方法是银卤化物不溶于水,如果水被选为溶剂,AgCl损失不可逆转的。然后被困在洪水中的碳正离子溶剂。
最后,它仍然是同样的现象。我们是否使用Brønsted酸或路易斯酸,的共轭酸总是更好的离去基团,酸可以帮助获得置换反应继续以更快的速度比。
在下一篇文章,让我们来比较一下N1和年代N2反应。
笔记
01焊接、结构和共鸣
- 我们怎么知道甲烷(CH4)是四面体吗?
- 杂化轨道和杂交
- bdapp.
- 轨道杂化和债券的优势
- σ键有六种:π键
- 一个关键技能:如何计算形式电荷
- 部分费用给线索电子流
- 四个分子间作用力以及它们是如何影响沸点
- bdappcom
- 如何使用电负性来确定电子密度(以及为什么不相信形式电荷)
- 介绍了共振
- 如何使用弯曲的箭头来交换共振形式
- bdapp1中国有限公司
- 如何找到最好的共振结构通过应用电负性
- 评估与负电荷共振结构
- 评估与正电荷共振结构
- 探索共振:Pi-Donation
- 探索共振:Pi-acceptors
- 总之:评估共振结构
- 画共振结构:3避免常见的错误
- 如何理解应用电负性和共振反应
- 债券杂交实践
- 结构和成键练习测验
- 共振结构的实践
02酸碱反应
03烷烃和命名法
04构象和环烷
05年有机反应的底漆
- 最重要的问题,当学习一门新反应
- 4反应的主要类Org 1
- 学习新的反应:电子移动如何?
- (为什么)电子流如何
- 第三个最重要的问题,当学习一门新反应
- 7因素稳定负电荷有机化学
- 7因素稳定有机化学中正电荷
- 常见错误:正式指控可以误导
- 亲核试剂与亲电试剂
- 弯曲的箭头(反应)
- 弯曲的箭头(2):最初的反面和最终的正面
- 亲核性与碱性
- 的三个类亲核试剂
- 是什么让一个好亲核试剂?
- 是什么让一个好的离去基团?
- 3因素,稳定的碳正离子
- 三个因素破坏碳正离子
- 过渡态是什么?
- 哈蒙德的假设
- 格罗斯曼的统治
- 首先画丑陋的版本
- 学习有机化学反应:一个清单(PDF)
- 介绍加成反应
- 介绍了消除反应
- 介绍自由基取代反应
- 介绍了氧化裂解反应
06自由基反应
07年立体化学和手性
08年置换反应
09年消除反应
11SN1 SN2 / E1、E2的决定
12烯烃的反应
- 烯烃E和Z符号(+顺/反式)
- 烯烃的稳定性
- 加成反应:消除的相反
- 选择性与特定的
- 在烯烃加成反应的区域选择性
- 烯烃加成反应的立体选择性:Syn vs反加法
- 马氏的HCl烯烃
- 烯烃Hydrohalogenation机制以及它如何解释马氏规则的像
- 箭头和烯烃加成反应
- 除了模式# 1:“碳正离子通路”
- 重组在烯烃加成反应
- 溴化烯烃的
- 烯烃的溴化:机制
- 烯烃加成模式# 2:“三元环”的途径
- 硼氢化反应,烯烃的氧化
- 硼氢化反应烯烃氧化机制
- 烯烃加成模式# 3:“协同”的途径
- Bromonium离子形成:一个(小)Arrow-Pushing困境
- 第四个烯烃加成模式——自由基
- 烯烃的反应:臭氧分解
- 简介:三个关键的家庭烯烃反应机制
- 钯碳催化加氢(Pd / C)
- OsO4(四氧化锇)Dihydroxylation烯烃
- m-CPBA (meta-chloroperoxybenzoic酸)
- (4)-烯烃合成反应地图,包括烷基卤化物的反应
- 烯烃反应实践问题
13炔的反应
14醇、环氧化合物和醚
- 醇-命名法和属性
- 醇可以作为酸或碱(以及为什么它重要)
- 醇的酸度和碱度
- 威廉姆森醚合成
- 威廉姆森醚合成:规划
- 从烯烃醚,叔卤代烃和Alkoxymercuration
- 醇通过酸催化醚
- 劈理的醚酸
- 环氧化合物醚家族的离群值
- 的环氧化合物与酸
- 环氧开环与基础
- 卤代烃与醇
- 甲苯磺酸盐和甲磺酸
- PBr3和SOCl2
- 消除反应的醇
- 消除醇与POCl3烯烃
- 酒精氧化:“强大”和“弱”氧化剂
- 阐明酒精氧化反应的机制
- 分子内反应的醇类和醚类
- 保护组醇
- 硫醇和硫醚
- 计算一个碳的氧化态
- 在有机化学氧化和还原
- 氧化梯子
- SOCl2机制醇烷基卤化物:SN2和SNi
- 酒精反应路线图(PDF)
- 酒精反应练习题
- 环氧化物反应测试
- 氧化和还原练习测验
15有机金属化合物
16光谱学
17二烯烃和MO理论
- 有机化学2中会发生什么
- 这些分子共轭吗?
- 结合有机化学共振
- π成键和反键轨道
- 分子轨道的烯丙基阳离子,烯丙基自由基和烯丙基阴离子
- 丁二烯的π分子轨道
- 二烯烃的反应:1、2和1、4
- 热力学和动力学产品
- 添加更多的1、2和1、4二烯烃
- s-cis和s-trans
- Diels-Alder反应
- 循环二烯烃和Diels-Alder亲二烯体反应
- Diels-Alder反应的立体化学
- 一昼夜的桤木挂式vs Endo产品:如何分辨它们
- 在一昼夜的HOMO和LUMO桤木的反应
- 为什么Endo vs挂式产品青睐Diels-Alder反应?
- Diels-Alder反应:动力学和热力学控制
- 复古Diels-Alder反应
- 分子内一昼夜的桤木的反应
- Regiochemistry Diels-Alder反应
- 应对和克莱森重组
- Electrocyclic反应
- Electrocyclic开环和闭包(2)——六个或八个π电子
- 一昼夜的桤木练习题
- 分子轨道理论实践
18芳香性
19芳香分子的反应
- 亲电芳香取代:介绍
- 激活和去活化组织在亲电芳香取代反应
- 亲电芳香取代的机制
- 昊图公司,Para -和元董事亲电芳香取代反应
- 理解邻、对位、和元董事
- 为什么卤素昊图公司-帕拉-董事?
- 双取代的苯:最强的捐赠者“赢”
- 亲电芳香取代(1)——卤化苯
- 亲电芳香取代(2)——硝化、磺化
- 东亚峰会(3)——傅克酰化和傅克烷基化反应
- 分子内的傅克反应
- 亲核性芳香取代(NAS)
- 亲核芳香替代(2)-苯炔机制
- 反应在“苄基的“碳:溴化和氧化
- Wolff-Kishner Clemmensen,羰基和其他减少
- 更多的反应芳香Sidechain:减少硝基和拜耳威利格
- 芳香族合成(1)——“操作”
- 合成的苯衍生物(2)-极性倒转
- 芳香族合成(3)-磺酰阻断组
- 桦树减少
- 苯的合成(7):反应地图和相关的芳香族化合物
- 芳香族合成反应和实践
- 亲电芳香取代实践问题
随着CH3OH醚裂解机制,而得到CH3Cl代替盐酸,不是吗?
哦,废话。固定的。谢谢! ! !
你好,
我认为我在这里看不到更大的图景——你写道,卤素可以制成更好的离开团体,但他们不是已经离开组首先好吗?
实际上你可以卤化物为更好的离开组通过使用一个适当的路易斯酸。银盐(如硝酸银)看到一些使用。也想想弗里德工艺反应——这用三氯化铝或FeCl3去除起始物料的卤化物。
SN2,应该非质子溶剂不? ? ?因为在酸碱质子条件下反应胜过SN2与亲核试剂就抓住质子哦? ?
不是完全清楚这个问题,但这是完全可能的SN2反应在质子溶剂。也有可能做的SN2反应在酸性条件下。唯一的警告是,酸不能*不可逆转地*使质子化的亲核试剂。是的,想做SN2在酸性条件下与强碱性亲核试剂如HO(-)或CH3O(-)会失败因为你提到的酸碱反应。然而如果亲核试剂Cl(-)或Br(-)或类似的,质子化作用是可逆的。
你好!谢谢你的解释!
我的问题是:在这最后一个图,最后一步,你怎么只画了一对电子的氧气?(这是三级结构-哦)
谢谢你!祝你有美好的一天!)
-orgo大学生
纯粹的懒惰。
在这个例子中你给sn1, hcl将率法。因此它是sn1可以二阶?
质子化作用会很快,相对于离去基团的损失。速度限制步骤仍然是一阶。
在银阳离子的反应被用于制造Cl更好的离去基团,你有一个电子对从氯的银离子机制。在下一步,然后有什么看起来像一个银之间的共价键和氯氯化银carbcation旁边。我只是想确认这确实是一种离子化合物形成(氯化银),我想。
我也想问的第一步反应的机制是路易斯酸碱因为一个氯原子之间形成共价键最初和银离子。我问这个,因为我认为,通常当白银债券具有离子和氯离子形成氯化银不认为刘易斯酸碱因为一个电子对还没有转移到形成一个共价键。然而,在这种情况下,我就在思考,氯是一个更大的分子的一部分,所以债券形式共价,因此这一步可以被认为是路易斯酸碱吗?
嗨,我在这里看不到更大的图景。可以是共轭酸较弱的基础如何?可以酸基地如何?
你以前见过这个,如果你想想。带水,水。水可以作为基础(捐赠的孤对电子),也可以作为一个酸(H +捐赠给HO -,如果你认为它是一个布仑斯惕酸,或接受一对电子H如果你认为它是一个路易斯酸)
如果有美索-或TsO和Br离开团体,他们哪一个是弱的基础和更好的离开groub吗?
*这是正确的顺序:OTS > > Br > Cl > F ?