芳香分子的反应
芳香族侧链上的更多反应:硝基还原和拜耳Villiger反应
最后更新:2022年10月15日|
在这里我们将介绍三个芳香取代基的新反应:
目录
- 芳香族取代基的另外三个反应
- 硝基的还原
- 氨基的保护
- 拜耳-维利格反应
- 拜耳-维利格反应的机理
- 《拜耳-维利格》中的迁移能力
- 混淆“酰胺”和“酯”的注意事项
- 摘要:硝基还原和Baeyer-Villiger反应
- 笔记
- 测试你自己!
- (高级)参考资料和进一步阅读
1.芳香取代基的另外三个反应
在芳香族化合物反应的这一节中,我们已经看到了两类重要的反应:
- 首先,有芳香族取代反应,其中键直接在芳香环上形成和断裂,产生新的取代基。我们可以在亲电芳香族取代中看到这一点,例如[看到帖子:亲电芳香族取代导论]
- 其次,有所有的取代基的反应在芳香环上。我们讲了金属羰基合物生成亚甲基(CH2)碳在以前的帖子[链接),以及将苄基C-H键氧化为C-Br和C-O键[链接]。
取代基的反应是需要掌握的一个重要部分,因为修饰取代基可以极大地改变芳香族环的亲电取代反应。看到的:理解Ortho, Para和Meta director]
例如,我们看到将C=O化简为CH2对环的反应性有巨大的影响,因为它转换了一个失活元-导成激活昊图公司- ,帕拉——导演。
在这篇文章中,我们将用另外三个芳香取代基的反应来结束这个子主题,包括:
为什么这些反应很重要?
学习反应的最终目的是能够将它们应用到日常生活中合成用我们自己设计的分子用更简单,更便宜的成分。每个反应都是一个“工具”,在允许特定特征键的形成和断裂方面具有特定的目的。你的“作坊”里的工具越多,你在设计有机化合物合成方面的能力就越大。
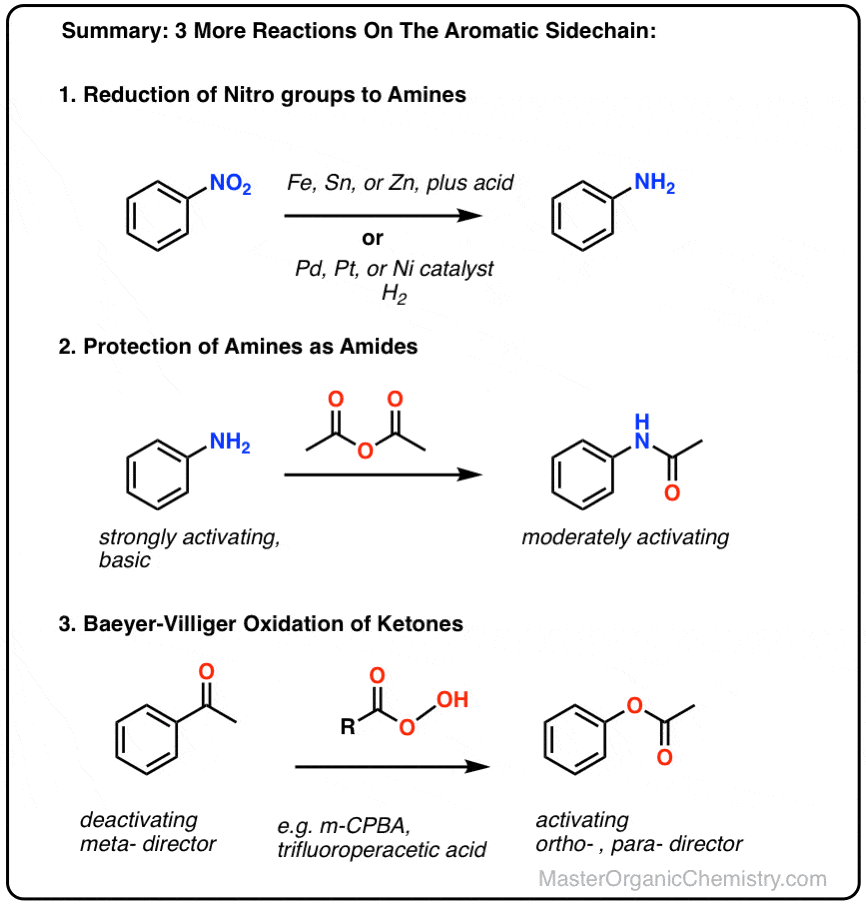
2.硝基的还原
芳香族取代基最重要的反应之一是硝基还原成胺.这可以使用两种通用方法:
- 加入容易氧化的金属,如铁(Fe),锡(Sn)或锌(Zn),在酸的存在下,如HCl(但通常只写为“H+”)会转化为NO2对NH2.
- 在钯、铂或镍催化剂上加氢也会转化NO2对NH2.
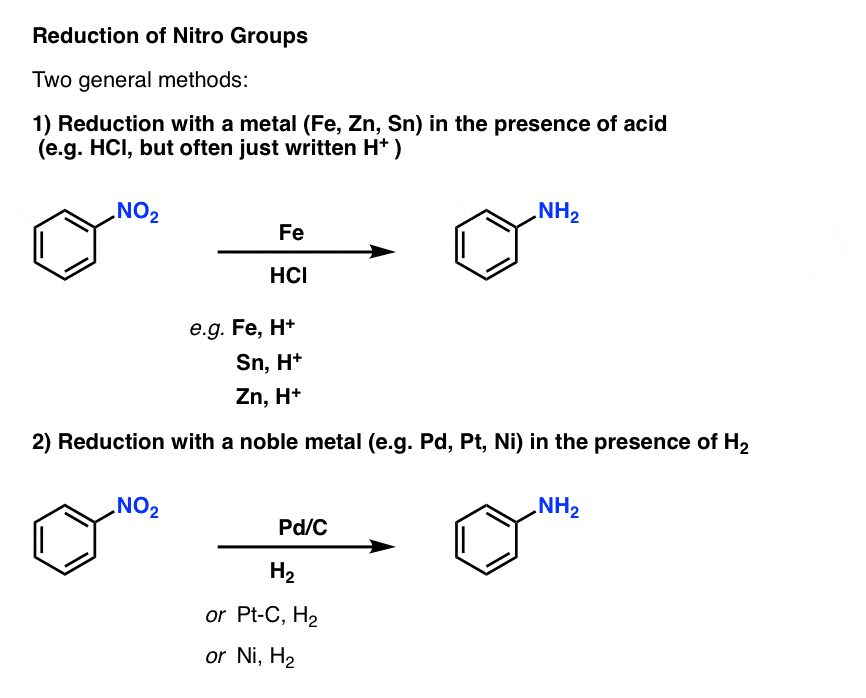
任何一种方法都是有效的,并且可以认为对我们的目的基本上是等效的。机制怎么样?[注1]
使用催化氢化的一个轻微优势是它可以在中性pH下进行,因此不会影响酸敏感官能团。
3.氨基的保护
硝基还原的一个最重要的特征是胺它能将一种强烈的失活,元-导向取代基变成强激活的,昊图公司- - - - - -,帕拉-指挥取代基。
然而,事实证明,这实际上可以引入一些新的问题!
- 首先,氨基是如此活跃,亲电芳香取代反应可以发生不止一次,而是多个时间,导致不需要的产品。
- 其次,孤对上胺是基本.需要Brønsted或Lewis酸催化剂的反应(如Friedel-Crafts反应,磺化反应或硝化反应)最终不会加速反应亲电试剂,而不是导致酸的协同作用胺孤对!
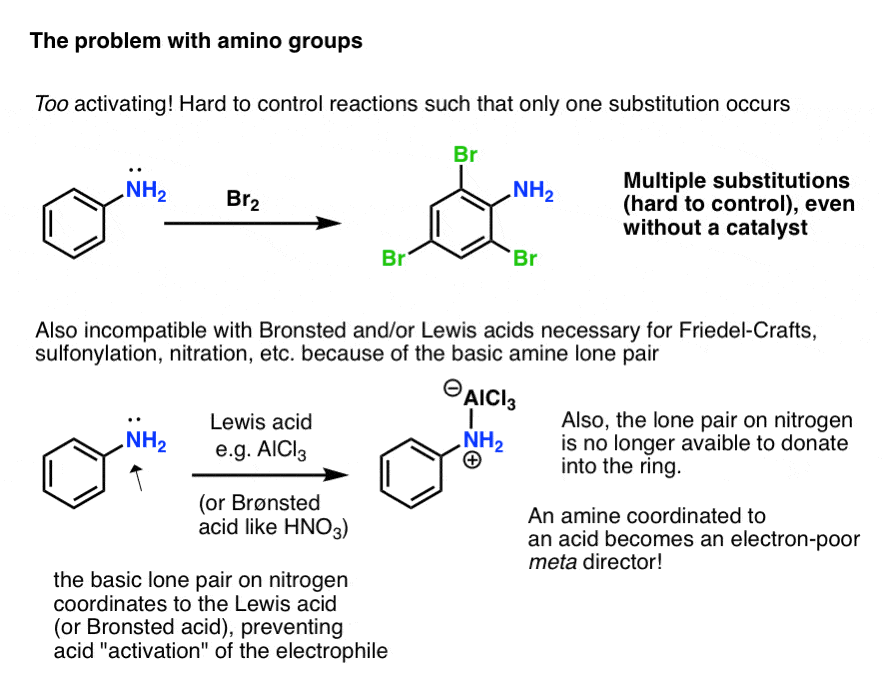
此外,这意味着氮上的孤对不再能够捐赠到芳香环中(通过“π捐赠”)。由于氮的电负性比碳强,配位到酸中的氮是吸电子的,实际上表现为a元——导演!
那么,我们如何驯服这匹自由氨基取代基的“野马”呢?
幸运的是,这相当简单。一种常见的方法是转换自由胺成一个酰胺用乙酸酐等试剂(Ac2O)。
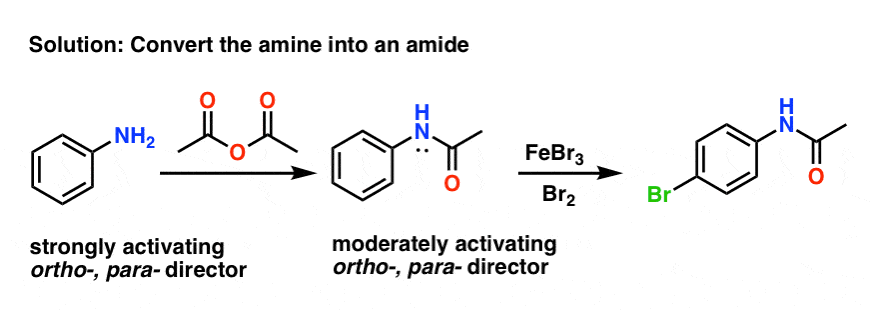
产生的酰胺仍然是一种昊图公司-,帕拉- director(注意氮上的孤对),但远不如自由电子活跃胺.
此外,酰胺与勃朗斯特酸和路易斯酸的相容性要比与游离酸的相容性好得多胺.
如果免费胺在此之后,可以通过使酰胺酸水解(水,Hbdapp平台2所以4、热)。
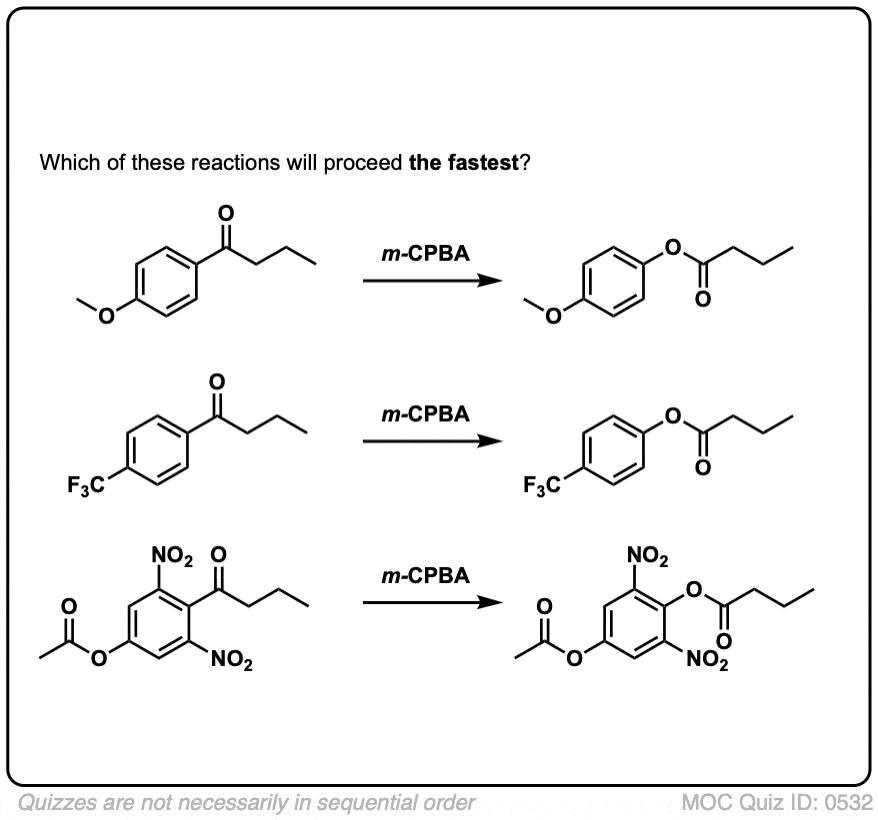
4.拜耳-维利格反应
对我们来说另一个有用的反应不局限于芳香酮是Baeyer-Villiger反应.治疗酮像过氧酸一样米-氯过氧苯甲酸(m -CPBA)或三氟过氧乙酸导致重排反应,其中一个氧原子插入到芳香环的碳和碳之间羰基碳,转换酮成一个酯:
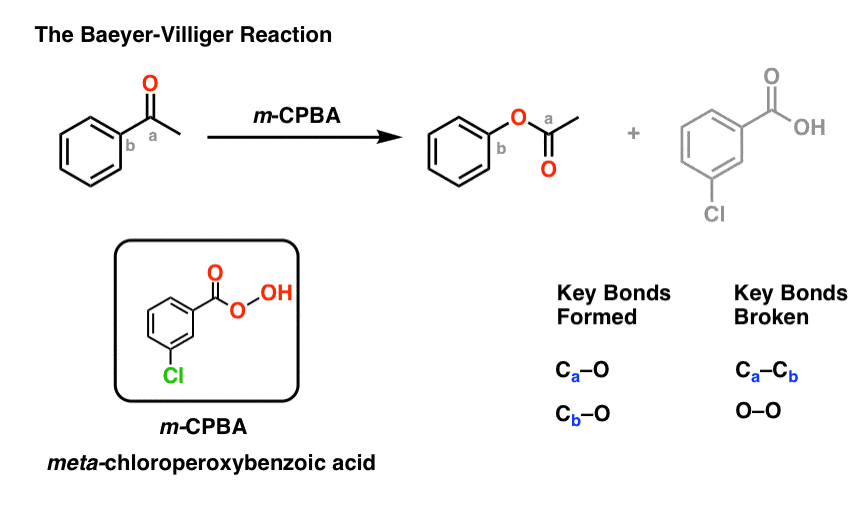
(不,像KMnO这样的“典型”氧化剂4或者铬酸盐PCC将不这样做。过氧酸起作用是有具体原因的!)
拜耳-维利格反应填补了我们合成方法“工具箱”中的一个重要空白。
到目前为止,我们已经学会了如何在芳香环上形成C-C, C- n, C- s和C-(卤素)键,但还没有学会C- o键。
还要注意拜耳-维利格,比如硝基的还原胺,转换为去激活,元导演羰基组到一个激活的,昊图公司-,帕拉-定向氧(氧上的孤对能给出π)
现在是有趣的部分。它是如何工作的?
5.拜耳-维利格机制
拜耳-维利格反应的第一步,过氧酸中的氧攻击酮,形成四面体中间体。质子转移会产生关键的中间产物:
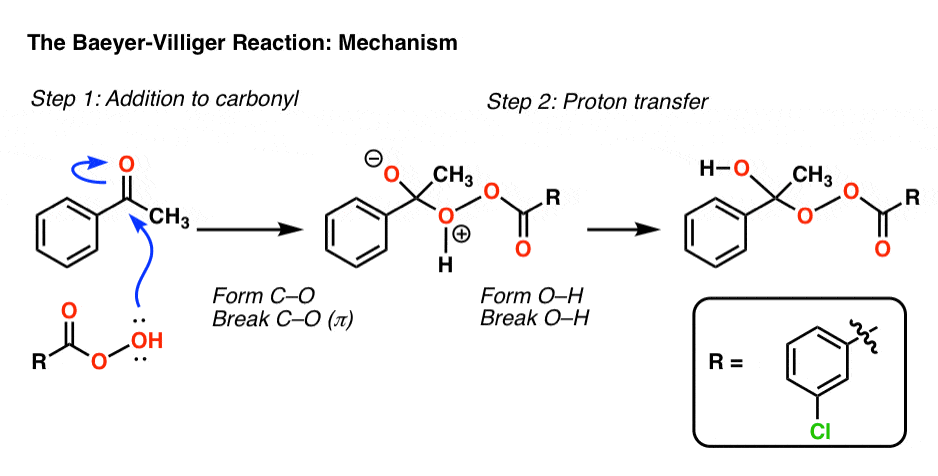
现在是关键的重排步骤。在这一步中,键的作用是A亲核试剂,攻击氧气并破坏弱(约35千卡/摩尔)O-O键。
看看你是否能在这一步中遵循箭头的指示:
- 在第一个曲线箭头中,C-C断裂,C-O形成
- 在第二个曲线箭头中,O-O断开
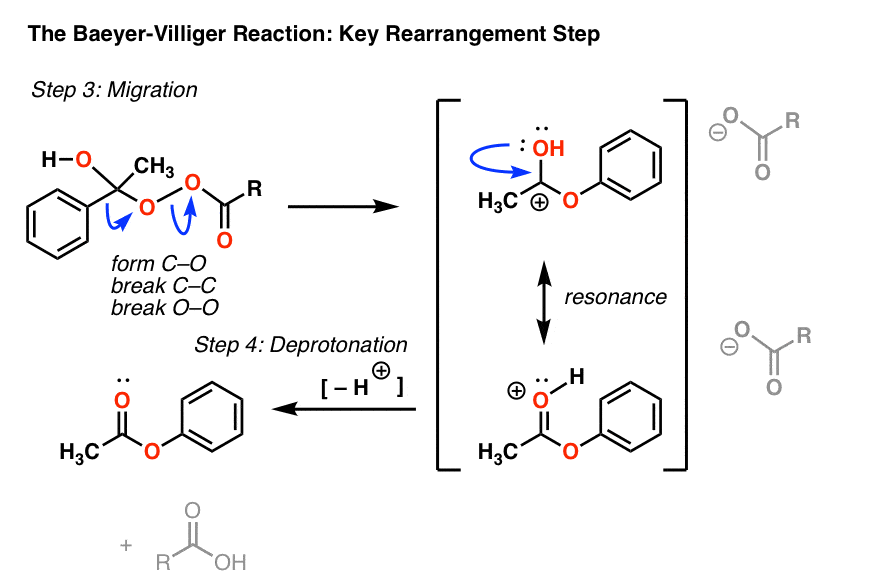
碳碳键的断裂产生碳正离子。然后我们可以画出一个共振形式氧原子的孤对和碳原子形成一个键,得到一个质子化的酯(第三个曲线箭头)。[注意-也可以在重排的同时画出这个,参见注2的例子]
然后它被去质子化共轭碱酸的)给最后的酯产品和m -氯苯甲酸。(不再是“过氧”苯甲酸,因为它失去了O-O键!)
在这样的重排反应中,我发现先画出产品的“丑”版本很有帮助,它有正确的连通性,但画得很差。点击此处查看“丑版”图片(图片链接)
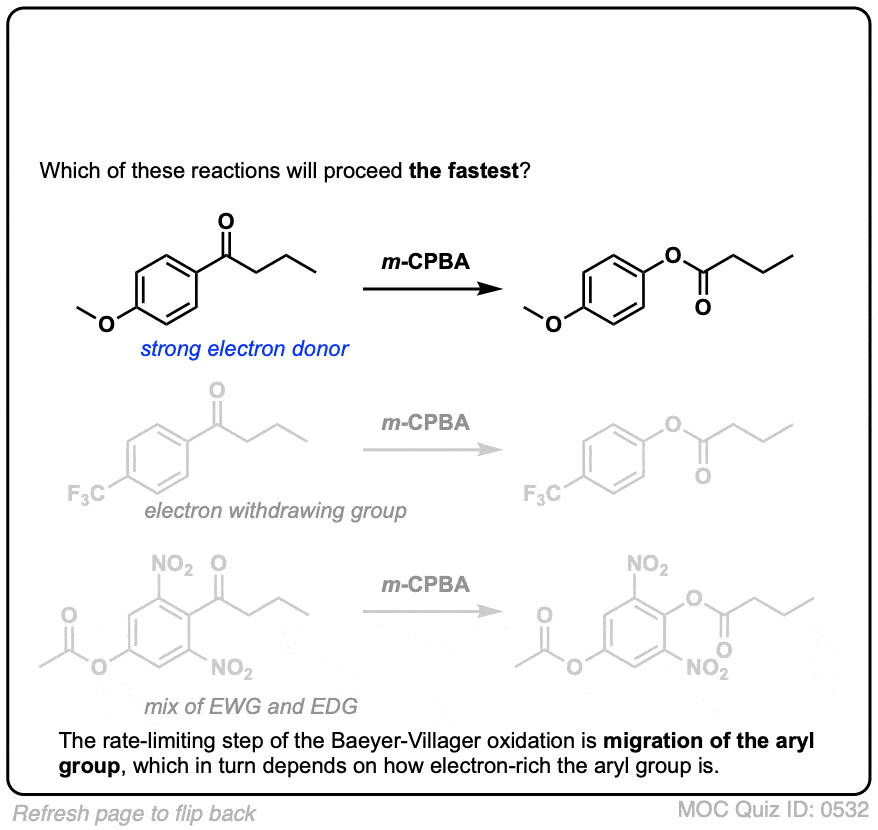
6.Baeyer-Villiger氧化中的迁移能力
好问题!这是一个非常好的问题,回答这个问题会超出标准课程材料的范围,所以我将在[注3]
简而言之,在迁移能力和碳正离子稳定性之间有一个总的趋势最大的例外苯基).
迁徙能力的大致顺序是:叔碳(最快)>仲碳,芳基(如C6H5>伯碳>甲基(最慢)。
(稍后在课程中胺),您可能会遇到Beckmann, Hofmann, Curtius和Schmidt重排,这是通过类似的迁移步骤发生的)。
闪回:硼氢化氧化和Sigma键作为亲核试剂
我们以前在哪里见过这样的重排步骤?
在有机化学中我们遇到的三类亲核试剂中[看到的:三类亲核试剂(孤对键、PI键和sigma键)作为亲核试剂的sigma键是迄今为止最难理解的。之前,我们看到键在以下情况下是亲核试剂:
- 1, 2-hydride转变(碳正离子重排)
- 烷基转移(碳正离子重排)
- 的氧化步骤在硼氢化反应
最后一个例子是最相关的。
你可能还记得,在硼氢化反应的氧化步骤中,过氧化氢阴离子攻击硼,形成硼上带负电荷的四面体化合物。像拜耳-维利格一样,有一个弱的O-O键,它被一个迁移的sigma键打破:
- 在第一个曲线箭头中,碳- b断裂,碳- o形成
- 在第二个曲线箭头中,O-O断开
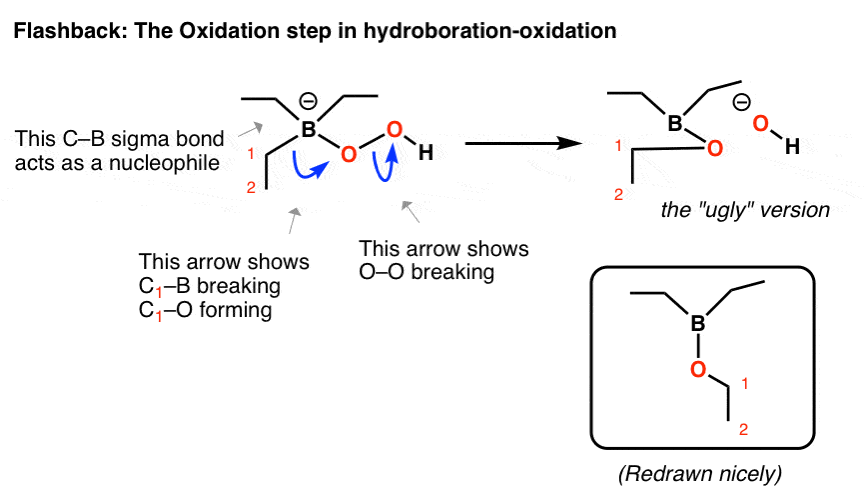
我建议先画“丑陋”的版本,以获得正确的连通性,然后重新画它。
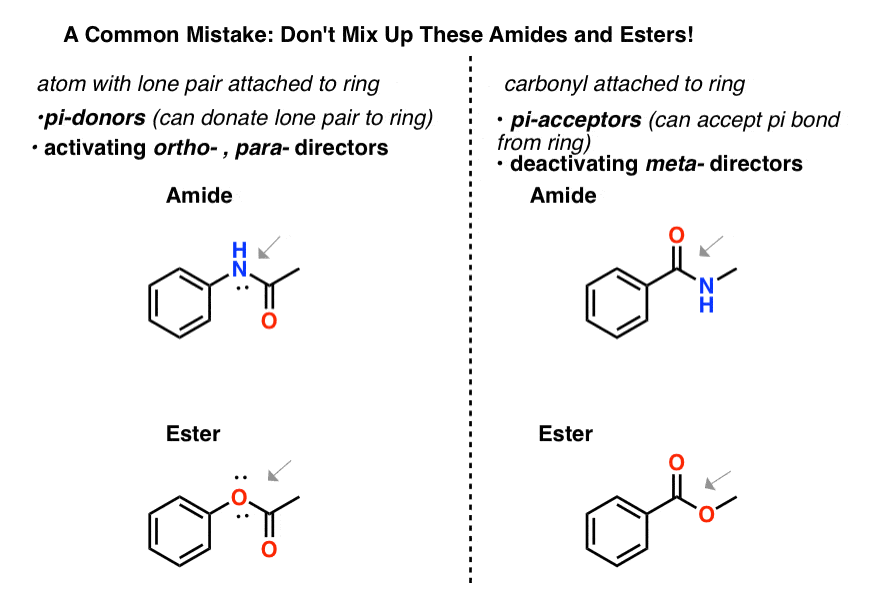
7.混淆“酰胺”和“酯”的注意事项
确保你能分辨酰胺和酯类这是昊图公司- - - - - -,帕拉-董事,助手和酯类这是元——董事。
- 一个原子附着在一个芳香环上,如果它有一对孤对,它就是原子昊图公司- - - - - -,帕拉-局长,既然有能力就把PI捐进戒指里。所以一个带N的酰胺连接到芳香环或者是an酯与O相连的芳香环将是昊图公司-,帕拉——董事。
- 一个羰基附着在芳香环上的是元-导演,因为它可以接受环上的π键。酰胺或者酯与羰基附着在芳香环上的会是一个元导演。
不要得到这两类酰胺和酯类搞混了!
8.摘要:硝基还原和拜耳-维利格氧化
信不信由你,我们已经讲完了环上的取代反应和芳香取代基的反应。
那现在怎么办?
是时候把这些反应组合成序列,并尝试在芳香分子的合成。
在我们的工具箱里有了这些反应,我们就能完成很多事情。
在下一篇文章中,第一个关于芳香合成的文章,我们将介绍一些基本原理。第二篇和第三篇文章将介绍一些综合策略。最后,我们可以花一些时间来练习问题。
笔记
注1。.硝基还原的机理一般不涉及,因为它很长(15+步),时间有限,而且机理的主题在课程的后续部分不会真正出现。这并不是说它不重要,只是不可避免地必须做出选择,硝基还原不可避免地最终出现在切割室的地板上。这是Sn和酸的反应大致的样子悬停弹出图像(链接至图片)
注2。C-O (π)键的形成在技术上只是一种共振形式,所以人们也可以把它画成一个协调的过程。悬停查看C-O π键参与的图像[(链接至图片)
好的,这远远超出了入门课程的内容,所以可以跳过。然而,问题仍然存在:为什么拜耳-维利格的迁徙顺序如此奇怪?
叔基>是仲基,芳基>是伯基>是甲基
它(大部分)的碳正离子稳定顺序(叔碳>次级>初级>甲基),除了芳基是介于次级和初级之间。到目前为止,我们已经看到了很多例子,这些例子最终表明芳基碳正离子比伯碳正离子更不稳定。那么是什么原因呢?
我们最好的假设是它实际上并没有经历C-C sigma键的直接迁移,而是通过芳香环的π系统对氧的攻击。这导致了一个离域的碳正离子(一种“arena离子”)通过共振高度稳定,它在到达最终的过程中迅速分解恢复芳香性酯产品:
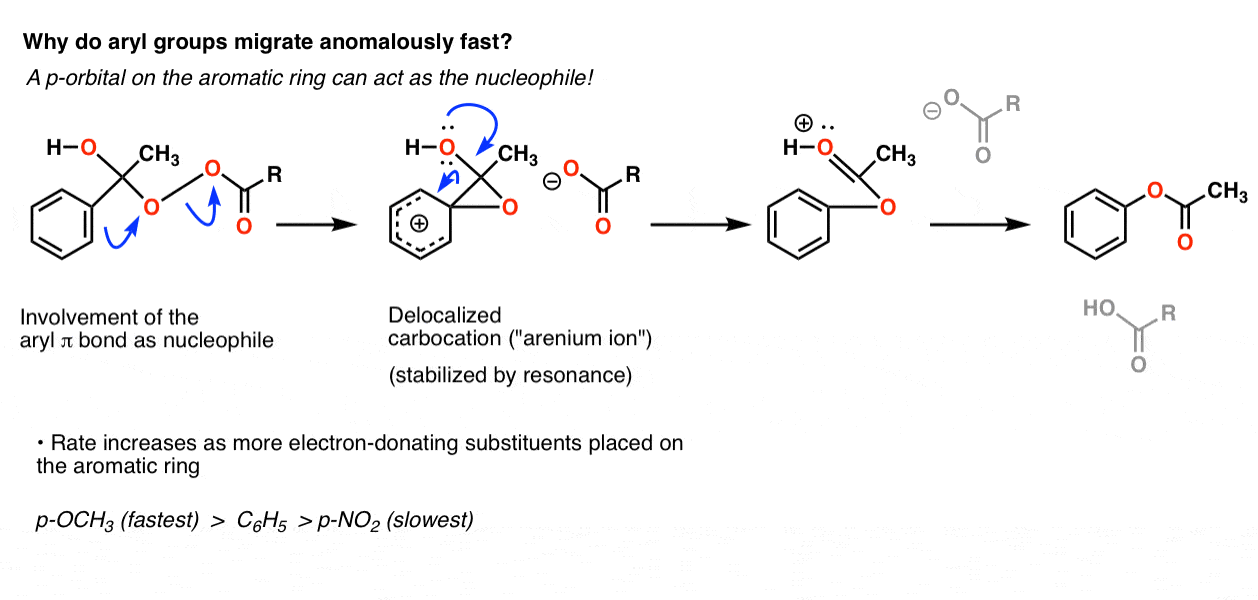
正如我们所期望的那样,芳香环上的电子捐赠基团(如O-CH3.解析:答案为C6H5和吸电子基团(如NO2)减慢速度。
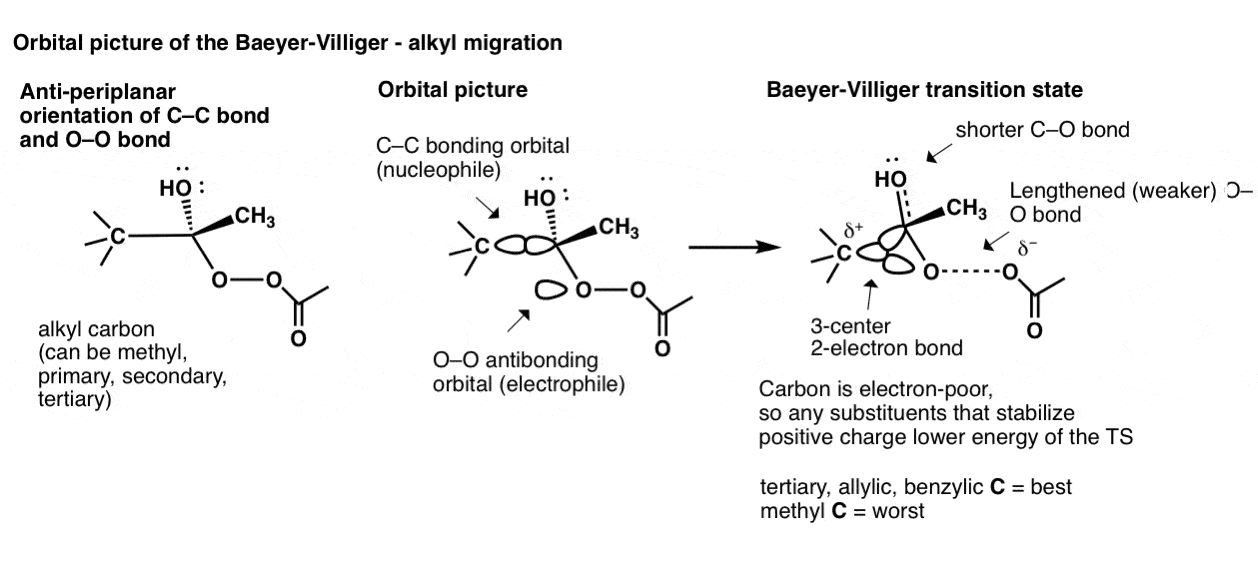
再深入一点,我们可以看一下轨道图烷基拜耳-维利格的迁徙。首先是碳碳键排列成反O-O键的-平面排列。然后C-C成键轨道开始与O-O反键轨道重叠,导致三个原子共享两个电子的过渡态!(不出所料,这被称为“3中心2电子键”。
这个过渡态的稳定性直接关系到这三个基团在烷基碳稳定正电荷。因此,三级(以及烯丙基的苯)碳迁移最快,其次是仲碳、伯碳和甲基碳。
芳基的迁移不仅仅涉及碳碳键;碳的p轨道也会参与进来!
那么在这个过渡态中发生了什么p-轨道变成了O-O反键轨道,形成了过渡态正电荷分散在芳香环的五个碳上;不一个3中心,2电子的键。
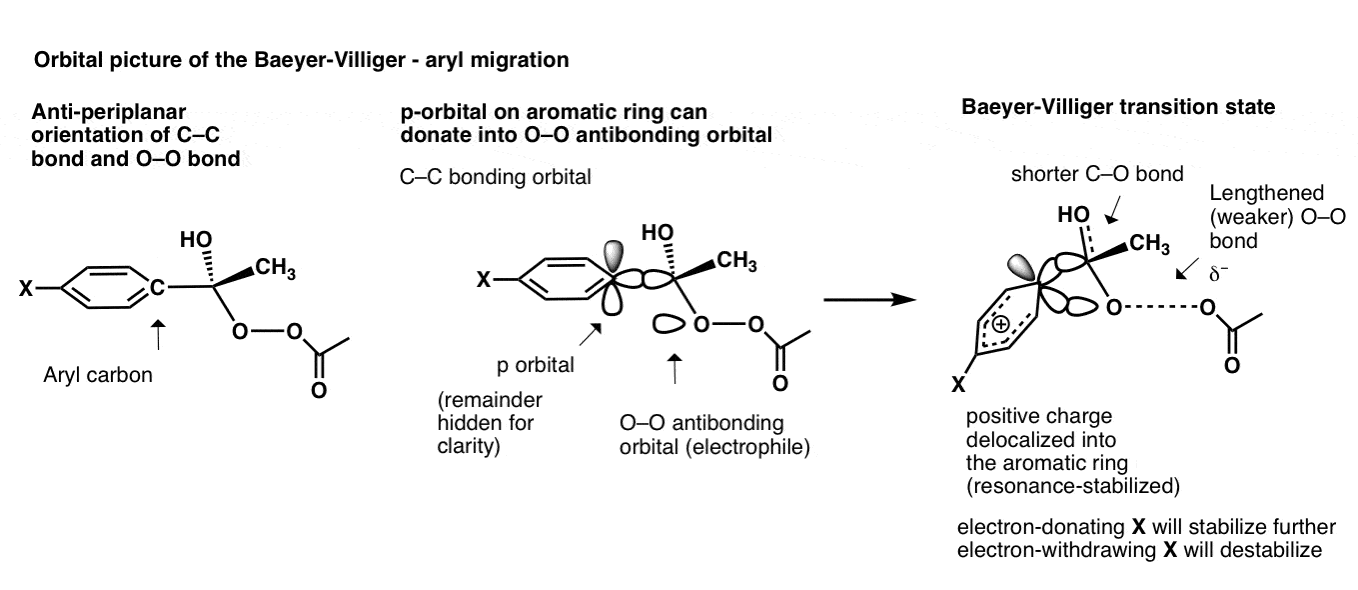
你可以想象,给电子基团X,比如OCH3.稳定过渡态(增加速率)和吸电子基团(如NO2)破坏过渡态(减慢速率)。
理论有机化学家Henry Rzepa有一篇很有用的博客文章讨论了拜耳-维利格的机制(特别是质子转移步骤)。在这里。
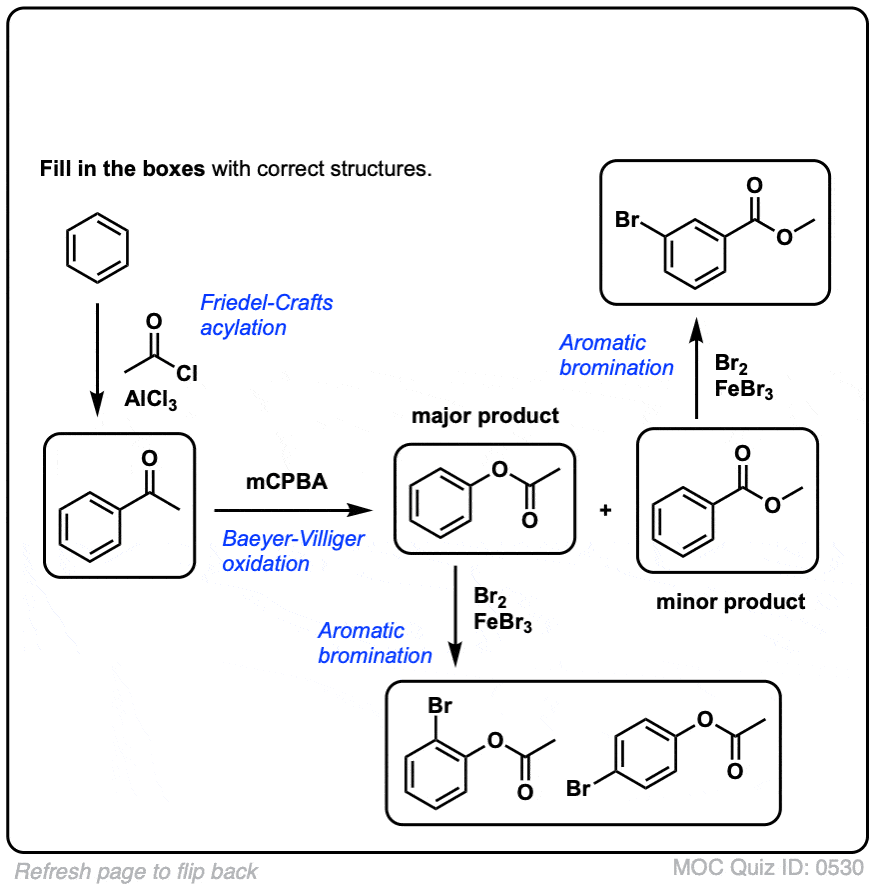
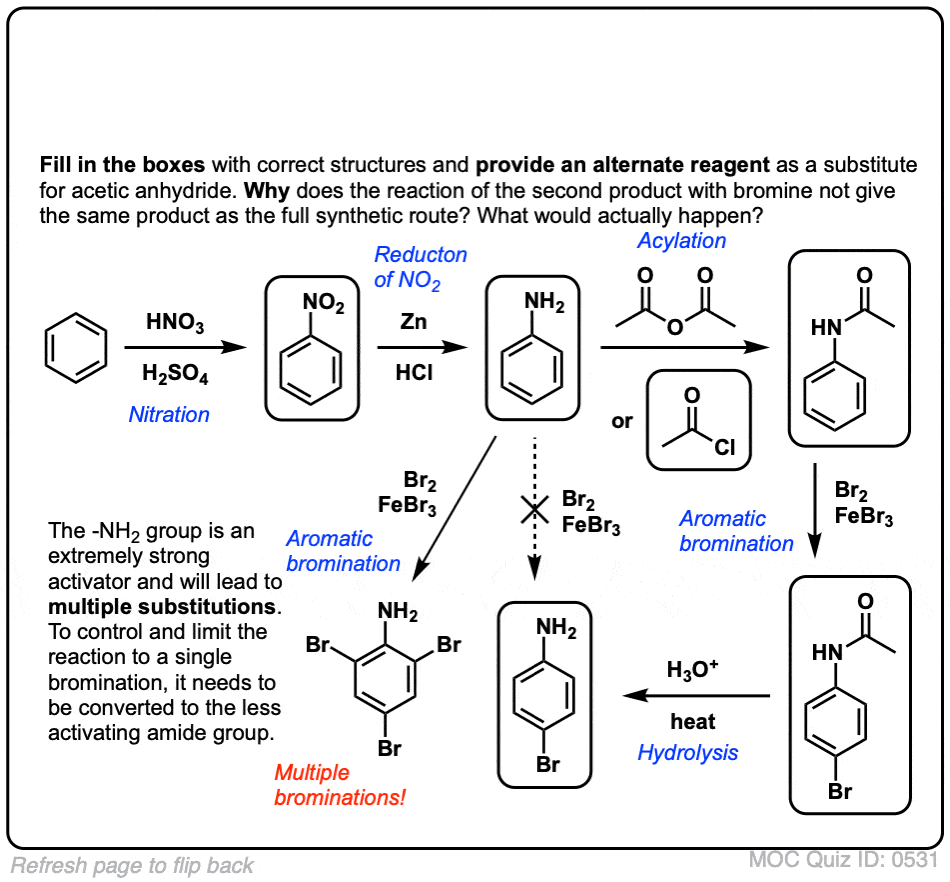
测试你自己!
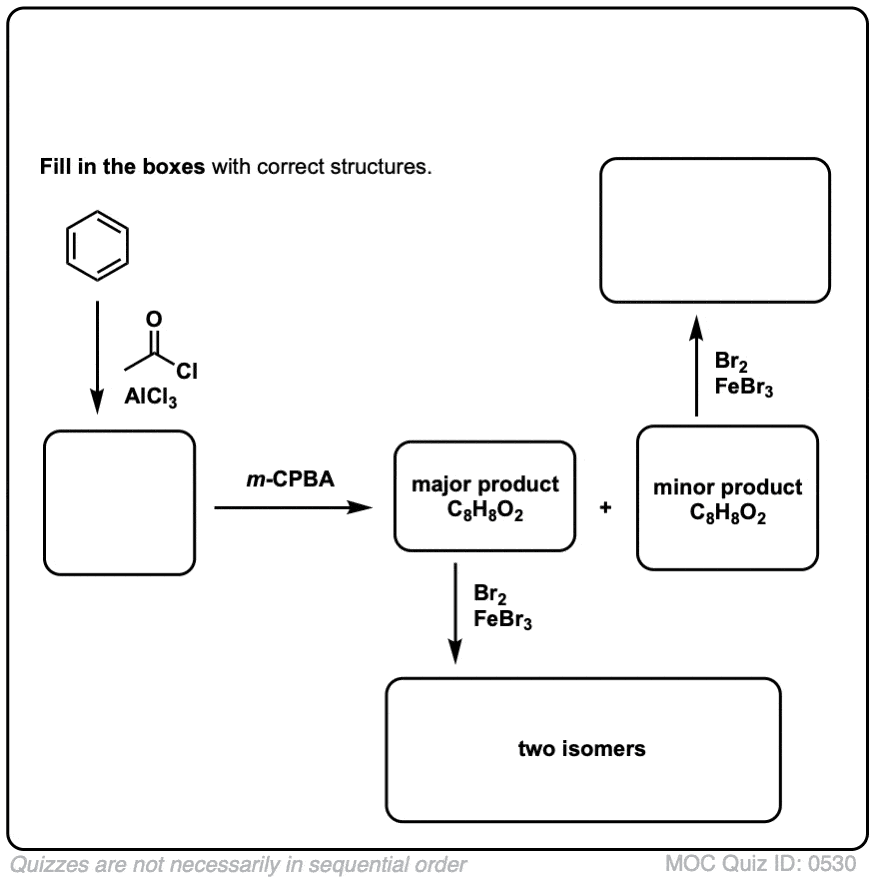 点击翻转
点击翻转
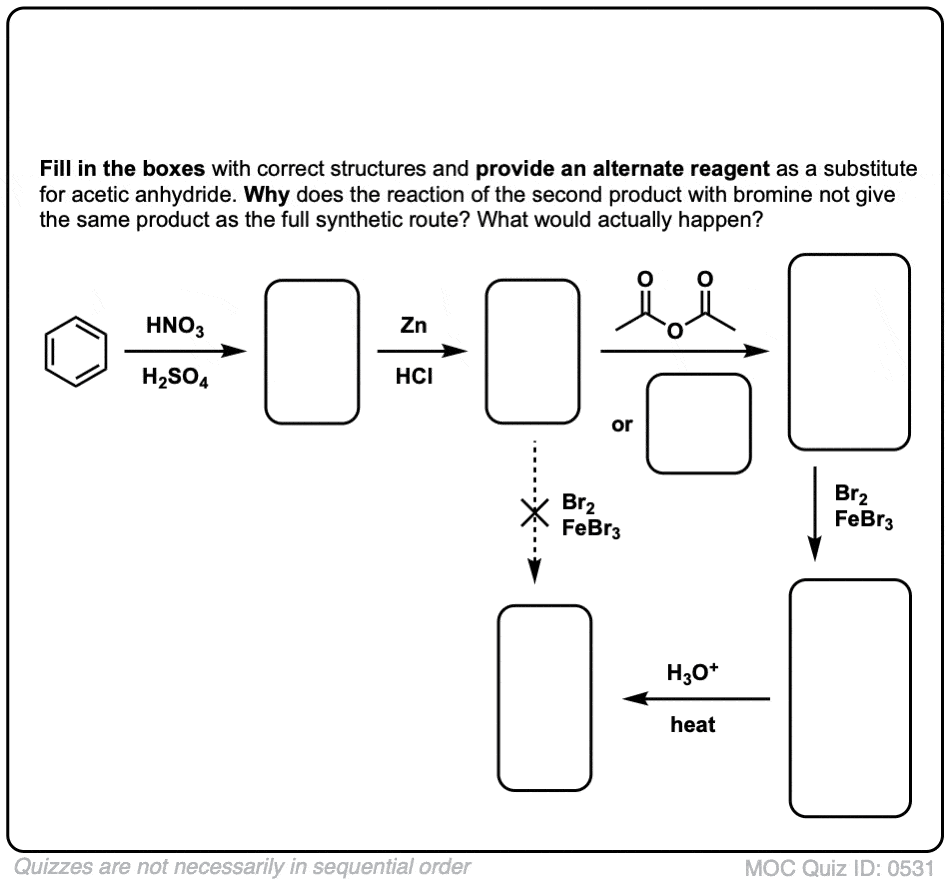 点击翻转
点击翻转
 点击翻转
点击翻转
(高级)参考资料和进一步阅读
Baeyer-Villiger氧化:
- 爱因威尔孔德卡罗琛里根斯酮
阿道夫·冯·拜耳,维克多·维利格
的误码率。1899,32(3), 3625年
DOI:10.1002 / cber.189903203151
诺贝尔奖得主阿道夫·冯·拜耳的这篇论文首先描述了现在被称为拜耳-维利格重排的现象,使用过硫酸钠和浓硫酸(卡罗酸)的混合物。 - 23.合成α -亚甲基- γ的方法。-内酯通过烯酮环加成
阿尔弗雷德·哈斯纳,哈罗德·w·平尼克和杰伊·m·安塞尔
有机化学杂志197843(9), 1774 - 1776
DOI:10.1021 / jo00403a032
本文提出了一个具有代表性的Baeyer-Villiger氧化实验过程。 - 拜耳-维利格氧化100年
迈克尔·伦兹和伯纳德·莫尼耶
Eur J. Org。化学。1999,4, 737年
DOI:1002 / (SICI) 1099 - 0690 (199904) 1999:4 < 737:: AID-EJOC737 > 3.0.CO; 2 b
本文综述了拜耳-维利格尔氧化反应的发展和历史,包括一个详细的历史观点。 - 酮和醛的Baeyer-Villiger氧化
克罗,g.r.。
Org。反应。1993年,251
DOI:10.1002/0471264180. or043.03
这篇长而详细的综述包括对Baeyer-Villiger氧化的机制、衬底范围、限制和实验程序的深入讨论。 - 拜耳-维利格反应:绿色程序的新发展
- j。十边缘,我。w。c。e。阿伦兹,还有r。a。谢尔顿
化学评论2004104(9), 4105 - 4124
DOI:10.1021 / cr030011l
这篇综述给出了拜耳-维利格氧化的现代观点,并描述了使用更“环保的氧化剂(如O2). - 硒化合物催化芳醛和酮与过氧化氢的Baeyer-Villiger氧化。一种制备苯酚的简便方法
Ludwik syp
合成1989,3., 167 - 172
DOI:1055 / s - 1989 - 27183
芳基在H上的迁移很少就像在一些例子中看到的那样。 - 控制拜耳- Villiger氧化和Criegee重排的初级立体电子效应的实验支持
理查德·m·古德曼和岸义人
美国化学学会杂志1998年,120(36), 9392 - 9393
DOI:10.1021 / ja982188g
一种简短的交流,其中一些底物用于B-V氧化产生的产品表明,立体电子效应是迁移能力的原因。岸信藤教授被认为是传奇化学家R. B. Woodward教授的哲学继承人,他在Woodward去世后继承了Woodward的研究小组,并继承了Woodward具有挑战性的全合成的遗产,最终合成了海洋天然产物孢粉毒素,被认为是迄今为止最具挑战性的合成。岸信介教授的名字也与一种反应有关,即野崎-希山-岸信介反应,其机理是偶然发现的。芳香硝基还原:
有各种各样的方法可以进行这种还原,可以通过氢化或在酸中使用金属进行还原。 - 2-AMINO-p-CYMENE
f·h·艾伦和詹姆斯·凡·艾伦
Org。Synth。1942,22, 9
DOI:10.15227 / orgsyn.022.0009
一个早期的例子有机合成,可靠和独立测试的合成有机实验室程序的来源。它使用氢化反应兰尼镍还原硝基。 - 氢化铝锂还原有机化合物的研究。3卤化物,醌类,杂氮化合物
罗伯特·f·奈斯特罗姆和威尔登·g·布朗
美国化学学会杂志1948年,70(11), 3738 - 3740
DOI:1021 / ja01191a057
LiAlH4也可用于还原芳香硝基,但这样会生成偶氮苯。这似乎是合成偶氮苯的一种非常方便的方法,就像对硝基溴苯的情况一样。”对硝基溴苯(在室温下)还原的产物,4,4 ' -二溴偶氮苯,不溶于水,仅微溶于醚,在加入稀硫酸后以结晶形式分离。它仅通过过滤和热水洗涤就能获得非常纯净的形式.” - 氯化亚锡在非酸性非水介质中选择性还原芳香族硝基化合物
贝拉米,欧
春节。列托人。1984年,25(8), 839 - 842
DOI:10.1016 / s0040 - 4039 (01) 80041 - 1
SnCl2在乙醇中,可作为ph中性的非水体系用于硝基还原。 - 铑配合物催化仲醇还原芳香族硝基化合物
刘飞,郑志宏
有机化学杂志1982年,47(15), 3018 - 3021
DOI:10.1021 / jo00136a046
在已知的数百种该反应变体中,Rh配合物可作为均质催化剂,通过转移氢化反应还原硝基。
如果我没有错,迁移能力是H(最快)>苯基>三级>二级>一级(最慢)
不是吗?
March / Smith,《高级有机化学》第5版,“对于不对称酮,近似的迁移顺序是叔烷基>仲烷基和芳基>伯烷基>甲基。
我会把H放在叔烷基之前,尽管很明显芳基会在H上发生迁移(很少发生)。https://www.thieme-connect.com/products/ejournals/abstract/10.1055/s-1989-27183
詹姆斯,就说一点。在测验的第二个问题中,你应该提到苯胺除了不可控或对烷基化外,还会形成偏烷基苯胺(根据在酸性条件下使用游离胺基团的缺点)。
谢谢你提供这么详细的事情