烯醇、烯醇化物
克莱森缩合和Dieckmann凝结
最后更新:2022年11月14日|
克莱森缩合(及其分子内的版本,“Dieckmann”凝结)
- 的克莱森缩合的一个基本反应吗酯类。
- 在克莱森缩合酯(2等价物)治疗基地(相当于1);产品是一个名为“beta-keto”酯,因为酮位于两个碳(β)酯羰基。
- 它形成新的碳碳键和减免切断和碳氢键。
- Dieckmann凝结的名字分子内的克莱森缩合,结果在5 -或六元环。
这里有一个具体的例子:
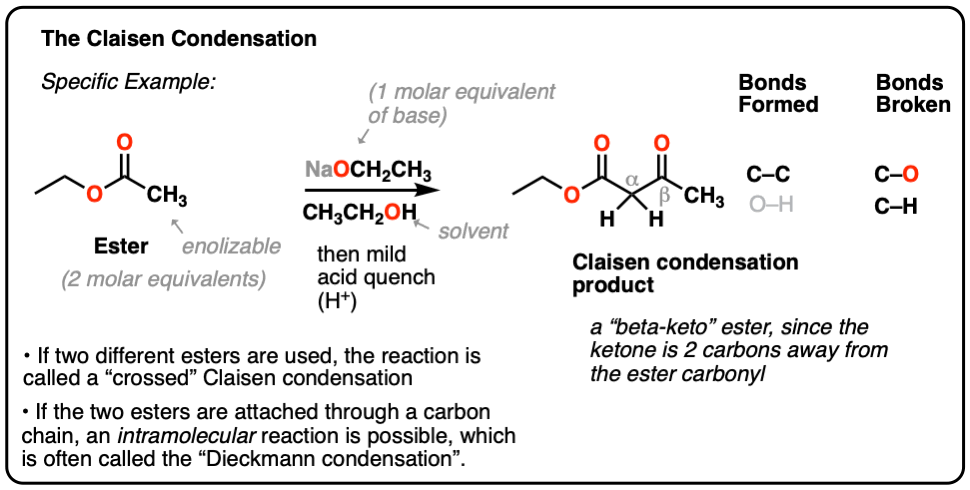
当两个不同的酯类反应,通常被称为“交叉”克莱森。
像许多反应,克莱森有一个分子内变体,Dieckmann凝结的名字,尽管它仍然是同样的反应,通过相同的机制。不同的铭牌上了车,同样的引擎。
学的机理是很重要的,因为它包含了很多的关键活性属性酯类——去质子化给烯醇化物,这些烯醇化物可以作为的亲核试剂,以及酯羰基可以接受addition-elimination反应(即。亲核酰取代)
在本帖里,我们将展示的每一步详细克莱森缩合机理,以及交叉克莱森密集的例子和Dieckmann冷凝。有测试问题最后将测试你的一些关键的概念。
表的内容
- 在克莱森缩合
- 形成酯的烯醇化物通过与强碱去质子化
- 亲核加成和消除羰基(也称为亲核酰替换)
- 去质子化的Beta-Keto酯产品
- 交叉克莱森密集的
- 分子内的克莱森冷凝——Dieckmann反应
- 结论:克莱森和Dieckmann
- 笔记
- 测试你自己!
- (高级)引用和进一步阅读
1。在克莱森缩合
当一个酯(2摩尔当量)用强碱处理(一个摩尔当量),获得一个新产品,关键的结果就是形成新的碳碳键和一个碳氢键和切断债券都破了。
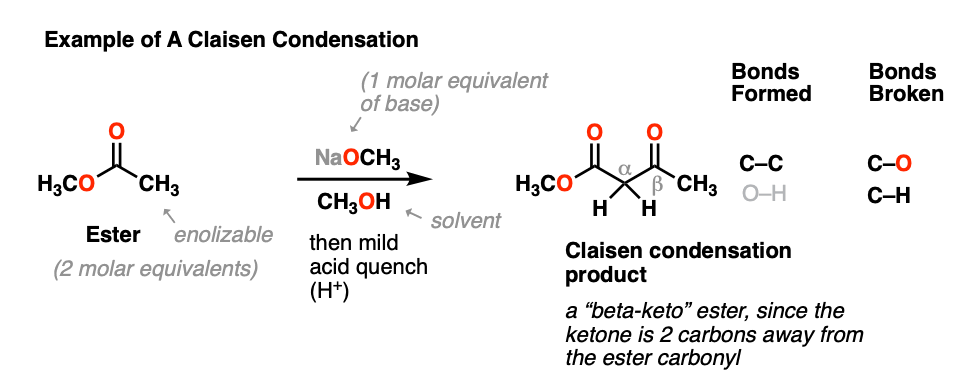
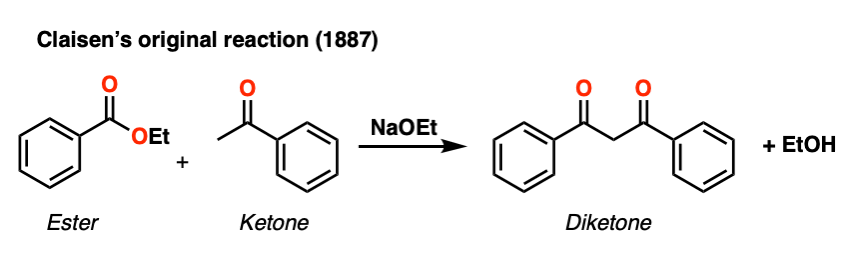
这个过程一般被称为克莱森缩合,路德维希·克莱森后,19世纪德国化学家(克莱森重排和克莱森适配器名声)在1887年报道的反应。(注1]
这个反应是一种连接两个酯类通过一个新的碳碳键给新产品称为“beta-keto”酯因为,以此得名酮存在两个碳(“贝塔”)酯羰基。
当然,关注关键结果(形成碳碳,打破碳氢键和切断)就像电影的最后一幕开始。问题是,我们如何到达那里?
我们会看到,克莱森的机制是一个大旅游的一些关键特性酯类,如与基地给烯醇化物,他们的反应如何,这些烯醇化物作为亲核试剂酯羰基可以接受addition-elimination与亲核试剂反应,最后生成的产品(beta-keto吗酯类)最终更多的酸性比开始酯类,热力学水槽抛出。
2。形成酯的烯醇化物通过与强碱去质子化
碳毗邻羰基被称为“α碳”。当α碳碳氢键,据说是什么enolizable,因为去质子化将导致一种叫做烯醇化物。alpha-carbons酮,酯类和其他相关分子数量级的酸性比烷烃的碳氢键自产生负电荷可以非定域化的碳氧通过共振。
的pK一个的α碳的酯类这使得他们大约10,约25吗6到107酸性比酮(pK一个大约18)。当处理一个像NaOCH强碱3去质子化的α碳可能发生,导致其吗烯醇化物。
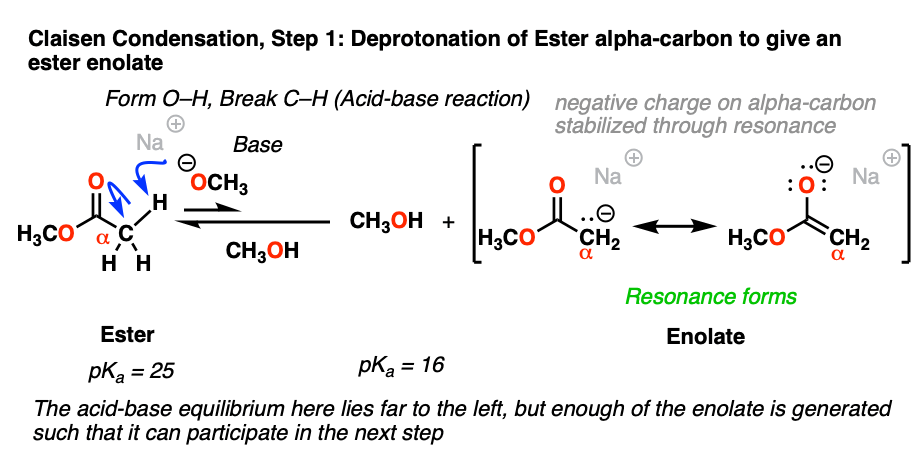
尽管平衡起始物料和青睐烯醇化物产品的8倍pKa单位(约108:1),由此产生的烯醇化物足够反应在随后的另外一步,最终所有的开始吗酯转化为最终的产品。
的醇盐基地(RO)通常是选择匹配酯或者组。为什么你认为可能吗?(见下面的测试]
3所示。亲核加成和消除羰基(也称为亲核酰替换)
正如我们所看到的很多次,烯醇化物都是不错的亲核试剂,作为亲核试剂他们倾向于债券的形式碳。(注2]
的烯醇化物碳就会攻击最好的亲电试剂现在,它的发生羰基碳的另一个等价的的酯。
这是到目前为止最重要的机制羰基组:亲核加成(或者,或者,“加法”)。随着亲核试剂形成一个新的债券羰基碳-氧π键断裂,产生了四面体中间。
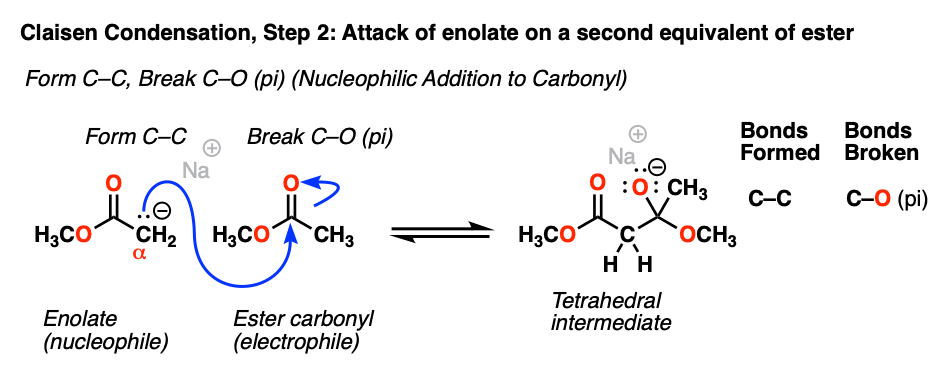
(注意,这个反应是可逆的。之间有一个平衡四面体中间和材料(即开始酯烯醇化物+酯)。)
现在我们来到第二重要的反应羰基功能组:消除(,或者1,2-elimination)。负电荷的氧四面体中间断开切断π键,这样做打破切断σ键。结果是一个新的酮和一个醇盐(罗- - - - - -)离去基团:
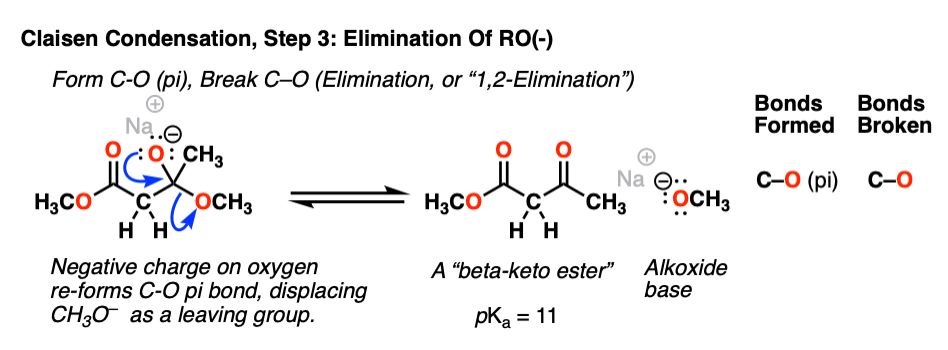
通常不会想到的一个醇盐作为一个好离去基团(pK一个乙醇是16,CH3CH2O- - - - - -强碱),但消除RO(-)仍然是一个更加有利的途径的逆转加成反应给酯烯醇化物(pK一个的酯= 25)。(注3]。
在一起,步骤2和步骤3,“亲核酰取代“自从或的酯已经被替换为CH2有限公司2R。
这1 - 2拳addition-elimination特征反应酰基组(RC (O)),我们将看到它一遍又一遍。
4所示。去质子化的Beta-Keto酯产品
在克莱森表明发生亲核酰取代,我们的反应机理近完成了。然而,仍有一个讨厌的宽松包扎。
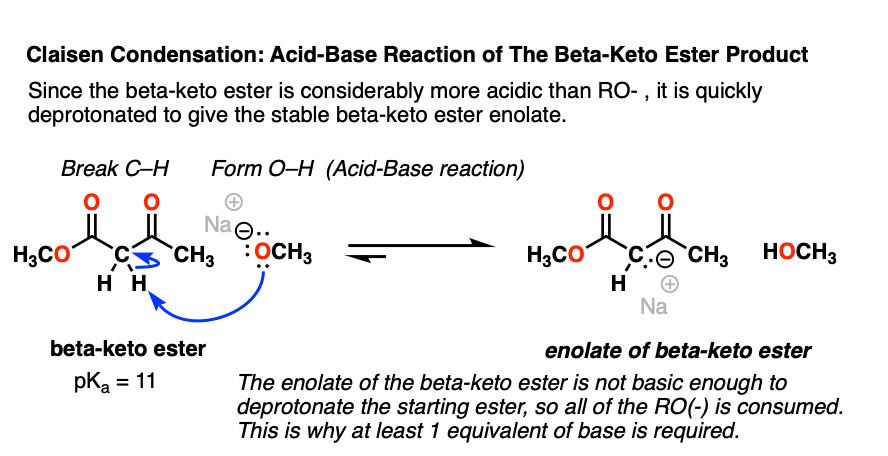
我们看到亲核酰替换的酯结果在一个新的强碱,RO (-)。
恰巧,克莱森的乘积,beta-keto酯,是一个相当强的酸(pK一个11)比共轭酸RO(-),卢武铉(pK一个16)。
正如我们所看到的无数次在酸碱反应,更强的酸+将较弱的酸碱性强和弱的基础。(参见:在有机化学酸碱反应]
这意味着醇盐基地很容易deprotonate beta-keto酯,给一个新烯醇化物——beta-keto酯。
为什么beta-keto酯(pK一个11)那么酸?注意,负电荷通过碳碳现在可以离域两个不同氧的电负性更强,能更好地稳定负电荷:
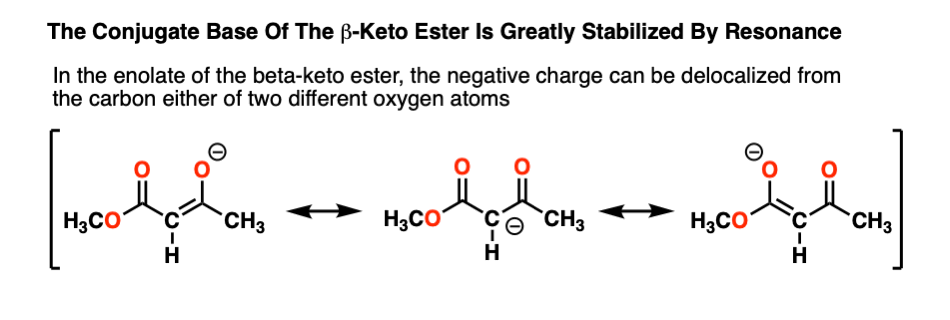
越“分散”一个负电荷,它就越稳定,一般来说。“不稳定的负电荷”通常与高碱度,反之亦然。
的烯醇化物非常稳定,事实上,它代表化学家经常称之为“热力学沉”。一旦形成,平衡回到起始原料是不利的烯醇化物坐落在反应瓶,不接受任何重要的反应。(注意4]
在这方面,它就像水流入水槽或桶,必须流“上山”出去。就像所有河流奔向大海,克莱森缩合,我们所有的酯起始物料最终皈依烯醇化物的beta-keto酯。(注5]
值得注意的是烯醇化物的beta-keto酯是一种弱碱,无法deprotonate开始的吗酯(pK一个= 25)。这就是为什么,为了让反应进行,我们必须使用至少有一个完整的基地。(这与醇醛反应,顺便说一下,在只需要催化基础反应产生以来RO (-))
一旦形成,无关烯醇化物的β-酮酯就坐落在反应瓶直到温和酸添加到淬火的反应。
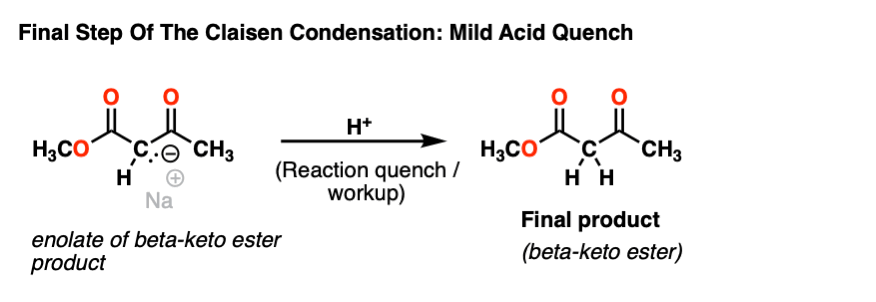
这给了我们beta-keto酯产品。
5。克莱森密集的“穿越”
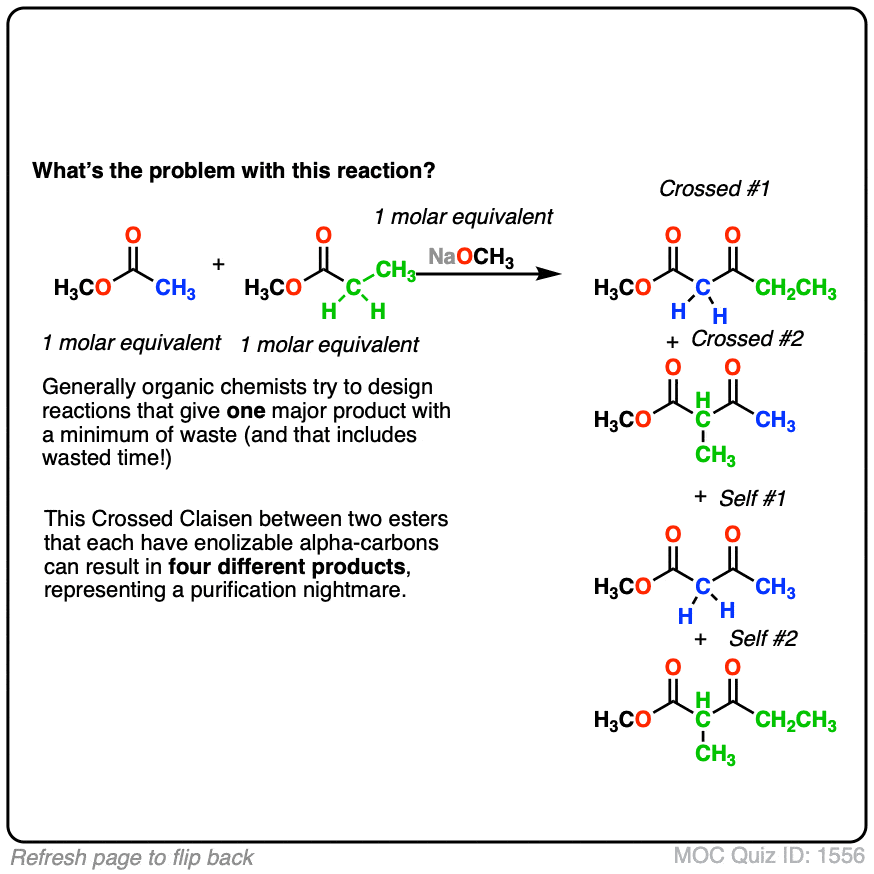
结合两个相同的酯类是不错,但这将是更好的结合两个吗不同的酯类。
这个可以做,它被称为“交叉”克莱森缩合。这里有一个例子:
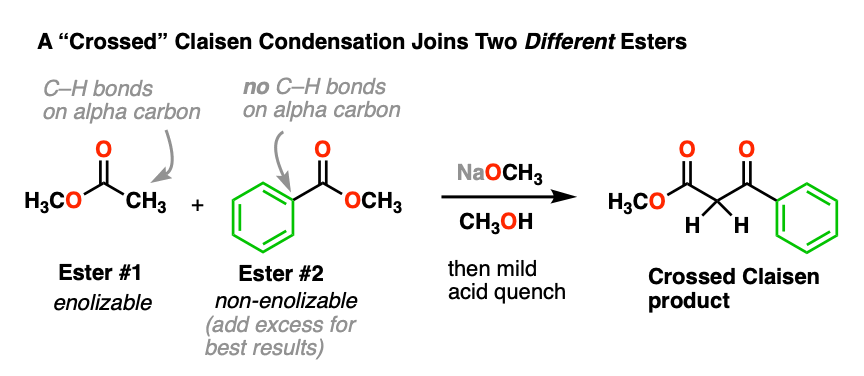
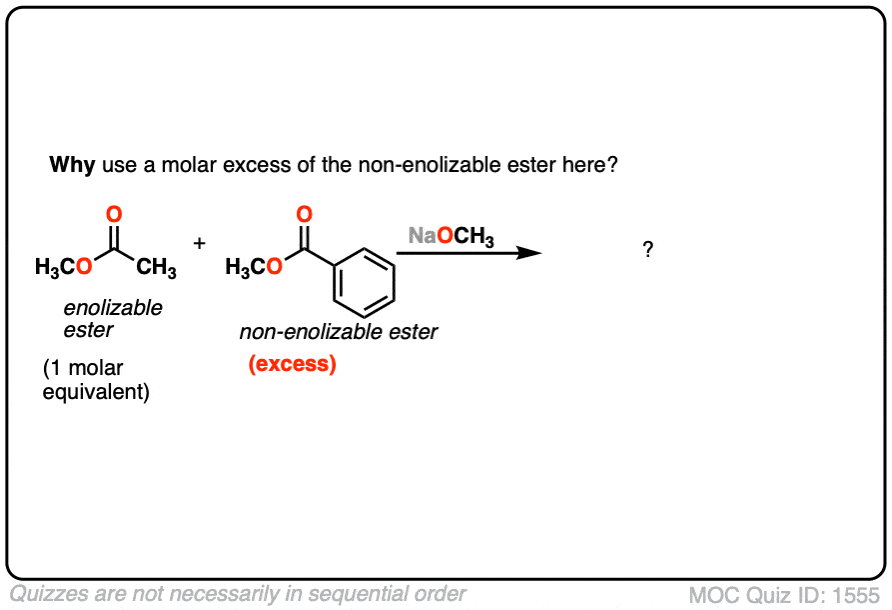
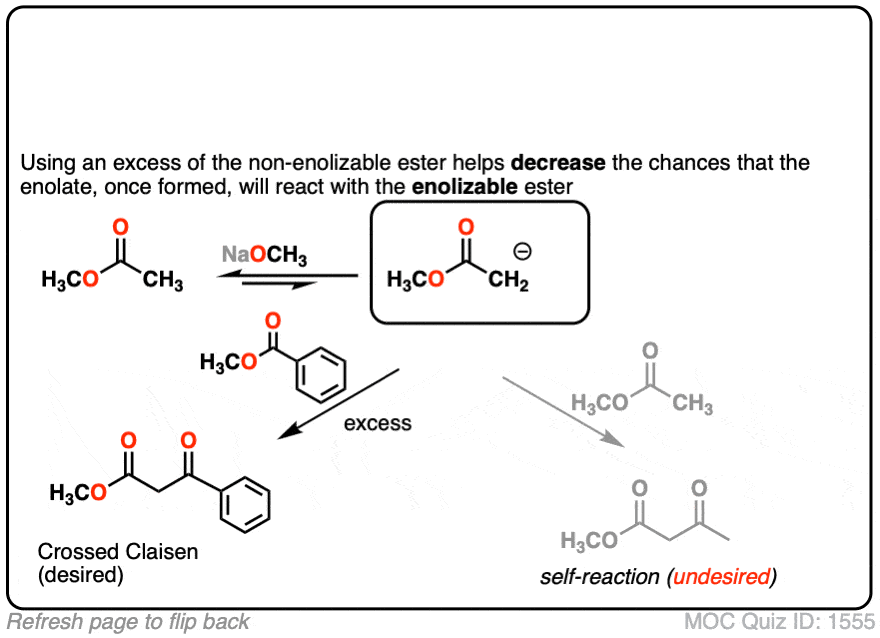
在这个反应中,我们有两个不同的酯类,但请注意,只有一个是“enolizable”——也就是说,有一个α碳以碳氢键-,因此形成一个的能力烯醇化物。这大大简化了的东西,因为只有一个烯醇化物亲核试剂可以形成。我们可以改善交叉克莱森的可能性,甚至通过增加过多的非enolizable酯。
- 你为什么认为它有助于增加过多的“非吗enolizable”酯吗?(看到测试]。
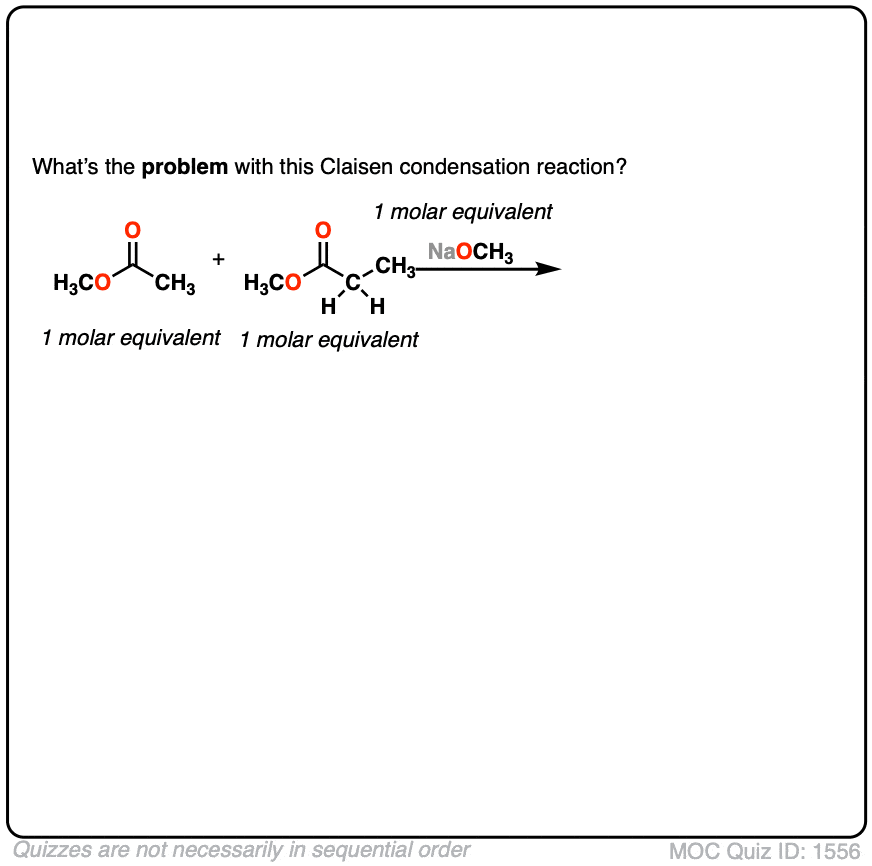
- 为什么使用两个是个坏主意吗enolizable酯类吗?(看到测试]
6。分子内的克莱森冷凝——Dieckmann反应
正如我们所看到的很多次,如果一个亲核试剂和一个亲电试剂通过干预碳链相互连接,结果将是一个新的环。
克莱森也不例外。虽然由于历史的原因,这个版本的克莱森往往由一个不同的名称——Dieckmann凝结,在某个w . Dieckmann成名研究这个反应在20世纪。这个名字并不重要;这是相同的反应,只有分子内。莎士比亚曾经说过,任何其他名字的反应将会仍然相同形式和打破债券。(注5]
我们经历了同样的过程在第一部分。首先,去质子化的α碳给一个烯醇化物。第二,攻击的烯醇化物在一个酯。自亲核试剂和亲电试剂通过碳链连接,这将导致一个新的戒指。
Dieckmann的下面是一个例子:
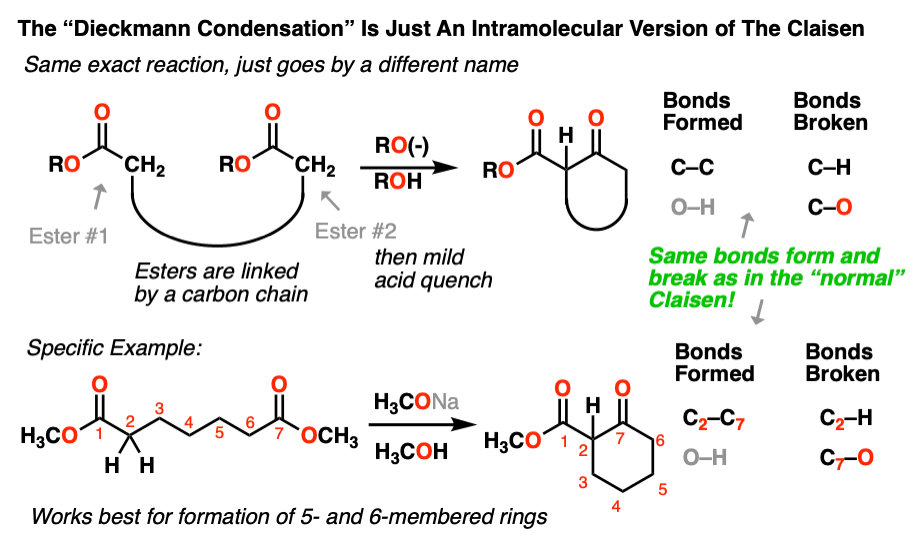
我们遇到与其他分子内反应,这个反应效果最好,当我们正在形成五和六元环。
你可能知道这个了,但是当你读到一篇关于“分子内的反应在这个网站上,它通常意味着,“当心这期末考试”。
7所示。结论:克莱森和Dieckmann
我们已经了解了克莱森缩合:
- 酯与醇盐就可以形成烯醇化物,他们是很好的亲核试剂
- 酯类可以接受addition-elimination与亲核试剂反应,或称为亲核酰替换。在克莱森缩合亲核试剂中华民国(O) CH2集团取代(RO)。
- 醇盐可以适当的离开组在这种情况下,因为它们比明显较弱的基地酯烯醇化物。
- 克莱森缩合的产物是一个beta-keto酯明显,这是一个更强的酸(pK一个= 11)比醇(pK一个= 16 - 17)或酯类(pK一个= 25)。
- 反应至少需要一个相当于以来基地烯醇化物的beta-keto酯产品不是一个足够强大的基地deprotonate开始酯。
- 克莱森缩合涉及到“穿越”烯醇化物一个酯作为一个反应亲核试剂用不同的(理想情况下非enolizable)酯给beta-keto酯。
- 当烯醇化物和酯在同一分子,克莱森缩合将形成一个环。这种分子内克莱森被称为Dieckmann缩合形成的,最适合5 -和六元环。
笔记
注1。虽然在本科教科书“克莱森缩合”一词通常是指一个的反应酯烯醇化物与另一个酯,是Geuther乙酰乙酸乙酯与乙酸乙酯在1863年。克莱森1887年的贡献是归纳过程其他烯醇化物;例如克莱森的1887年的论文酮烯醇化物反应一个酯。(见下面的ref)克莱森也理解机制做出了重要的贡献。
注2。格罗斯曼的“次优”的规则很方便的了解:“第二共振结构通常理解的化学行为提供了关键化合物”(从。”写作的艺术合理的有机反应机制”,2。患儿9页)。因此,即使“最好”烯醇化物共振形成氧的负电荷,“次佳”(碳负电荷)决定了反应性。
注3。较弱的基础,越好离去基团。(参见:是什么让一个好的离去基团]。所以即使我们通常认为RO -是很糟糕离去基团(共轭碱乙醇,pK一个16)拍的裤子了酯烯醇化物(共轭碱一个酯,pK一个25)而言的离去基团能力。
注意4。。您可能还想:如果烯醇化物良好的亲核试剂,这个为什么不与一个反应酯羰基,就像酯烯醇化物呢?一些除了一个酯羰基可能发生,但亲核攻击后,四面体中间(强基地)会很快回复到起始烯醇化物(弱基地)+酯。因为所有的步骤都在平衡,beta-keto酯烯醇化物是最弱的基地的所有物种平衡,beta-keto吗酯烯醇化物在这个反应是“热力学沉”。
注5。Dieckmann公平,除了他的贡献的发展分子内版本的克莱森缩合,他还发现了重要的通用克莱森反应的可逆性。(见英格尔德p。1173年,一个有用的账户)
反应的可逆性变得更加重要α碳变得越来越取代。有趣的是,克莱森beta-keto行不通的情况下酯不能enolize。像这样:
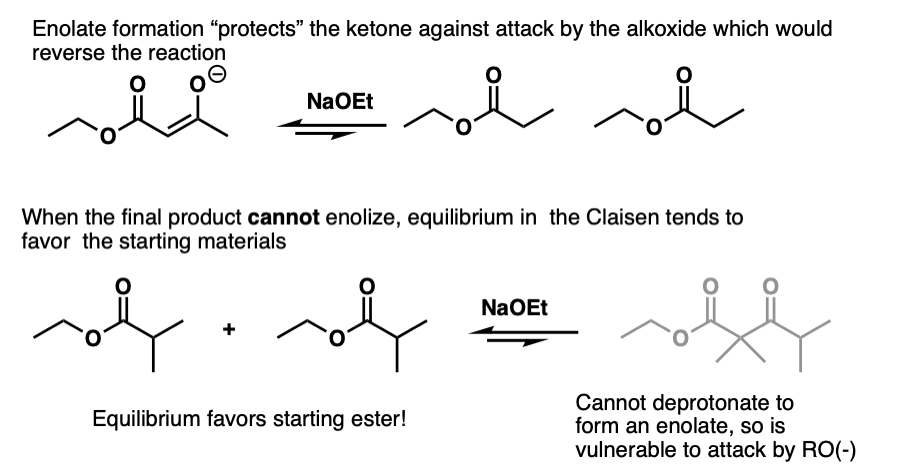
问题不在于克莱森不能发生,那就是最终产品可以接受逆反应和萧条打开产品。
的形成烯醇化物因此有助于“保护”酮对攻击的亲核试剂不仅热力学从酸碱的角度来看,也有助于防止攻击的亲核试剂。
测试你自己!
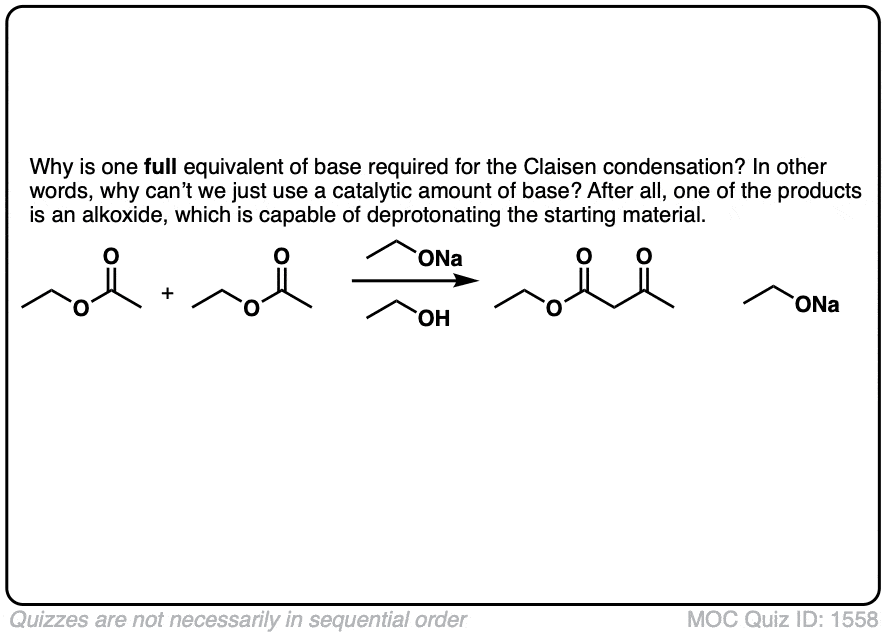
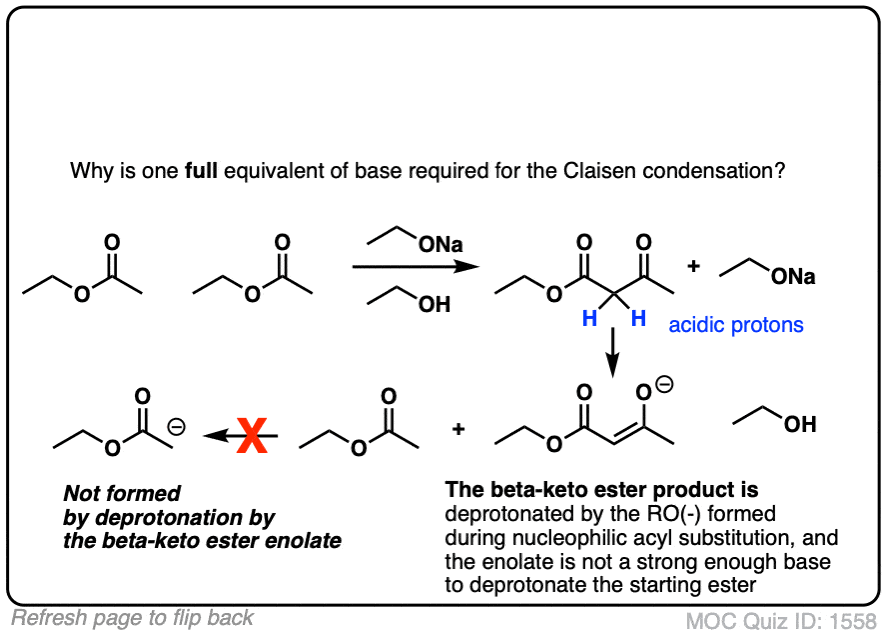
1。克莱森缩合反应中我们看到这里,基地(RO)的RO组是一样的酯。会发生什么如果他们不同吗?
 点击翻转
点击翻转
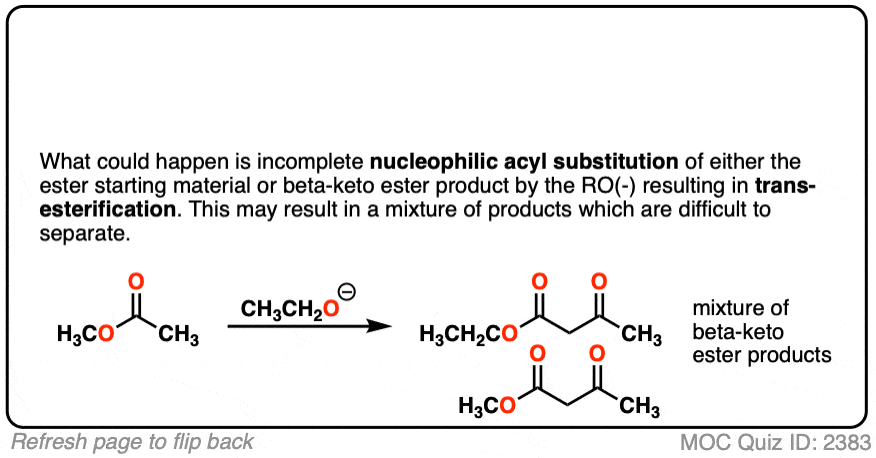
2。在交叉克莱森反应显示,只有一个酯是enolizable和非enolizable酯在过量补充道。为什么使用非吗enolizable酯在过剩?
 点击翻转
点击翻转
3所示。如果我们使用了两个会发生什么enolizable酯类在等量吗?
 点击翻转
点击翻转
4所示。你能想到一个变通方法成功地做了克莱森这样只有一个产品了吗?
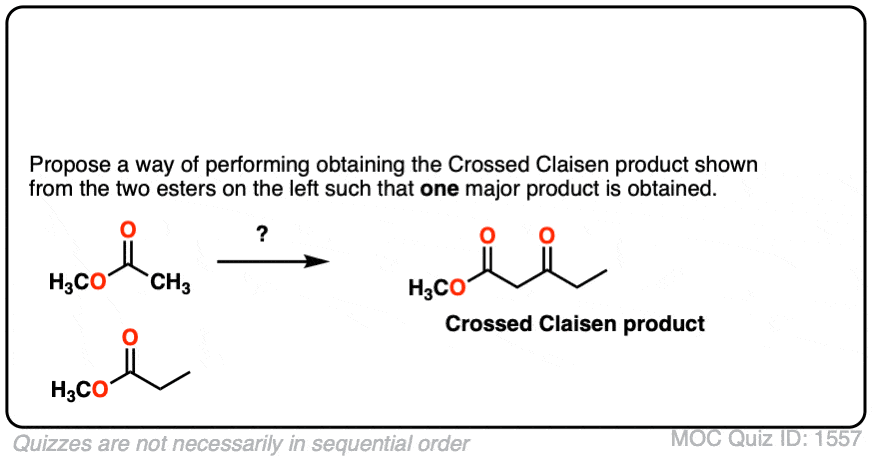 点击翻转
点击翻转
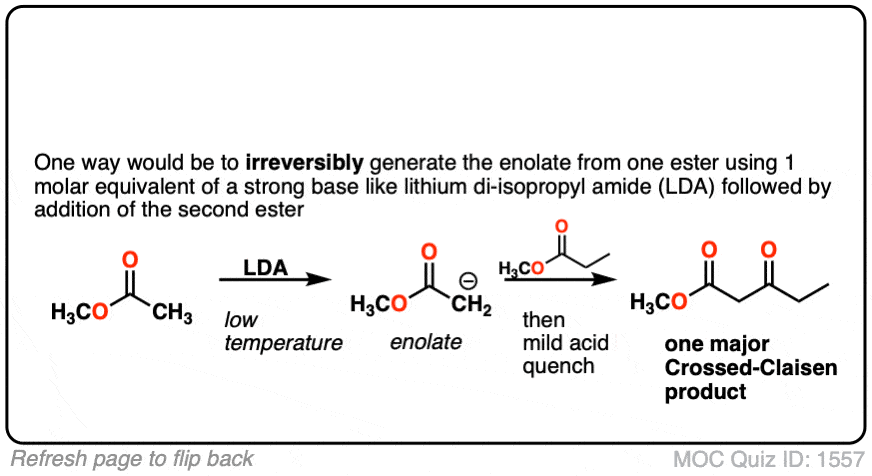
 点击翻转
点击翻转
6。以下beta-keto化学家试图形式酯Dieckmann凝结,但不成功。为什么不这Dieckmann冷凝发生?
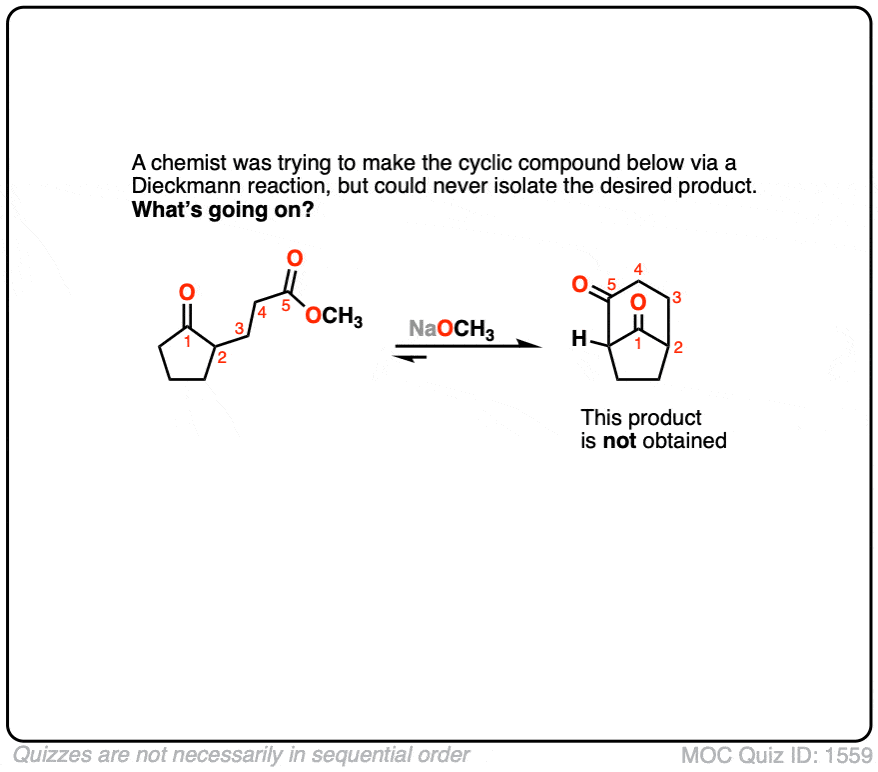 点击翻转
点击翻转
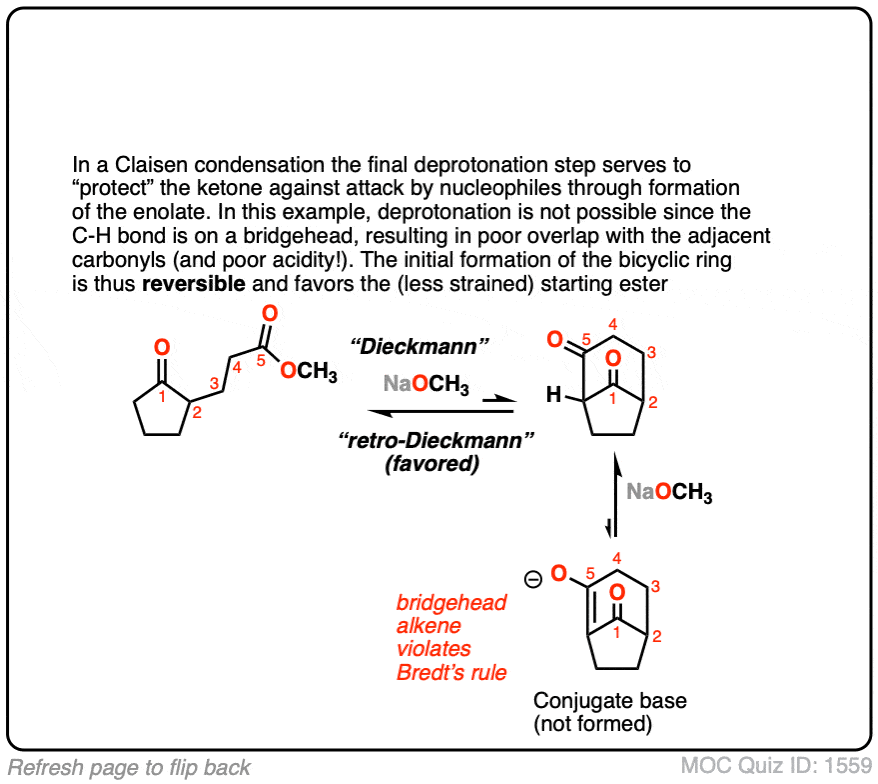
(高级)引用和进一步阅读
克莱森缩合也称为Claisen-Geuther反应后的第一人发布这一转型,路德维希·克莱森和a . Geuther。
- Untersuchungen超级死einbasischen Sauren
答:Geuther
拱门。制药。1863年,166年(2),97 - 110
DOI:10.1002 / ardp.18631660202
原始报告的反应被称为克莱森缩合。乙酰乙酸乙酯乙酸乙酯和基地的形成。 - Ueber Einfuhrung冯Saureradicalen在死去酮
l·克莱森
化学。的误码率。1887年,20.(1),655 - 657
DOI:10.1002 / cber.188702001150
这经常被引用为克莱森的第一反应,虽然它似乎是一个反应之间酮烯醇化物和一个酯,而不是一个之间酯烯醇化物和一个酯。见:https://zenodo.org/record/1425461 .X1EeLRNKh25
- 的乙酰乙酸酯凝结和某些相关的反应
查尔斯·r·豪泽;博伊德哈德逊,Jr .) E。
Org。反应。1942年,1,266 - 302
DOI:10.1002/0471264180. or001.09
有机反应、发布和维护的ACS的有机化学,是一种综合评价各种有机化学中转换。这个评论是第一个问题,1942年,涵盖了所有的实例直到克莱森缩合知道时间。提供详细的试验程序结束。的Dieckmann condensation is the intramolecular variant of the Claisen condensation. - 这苏珥是Kenntniss der Ringbildung来自Kohlenstoffketten
w . Dieckmann
化学。的误码率。1894年27(1),102 - 103
DOI:10.1002 / cber.18940270126
第一份报告由w . Dieckmann这个反应的分子内变异。 - Ueber cyklischeβKetoncarbonsaureester
w . Dieckmann
而已。Lieb。安。化学。1901年,317年(1),27 - 109
DOI:10.1002 / jlac.19013170104 - 克莱森缩合作为一个α-Alkoxy-cinnamate:简单路线合成乙基(2 s) 2-ethoxy-3 - propanoate (4-hydroxyphenyl)
垫t Linderberg,米凯尔Moge Sivaprasad Sivadasan
研发的有机过程2004年,8(6),838 - 845
DOI:1021 / op040006z
研发的有机过程(“OPRD”)也是一个好地方去寻找强大的有机转换,因为反应需要清洁,高收益,不需要扩大时非常高或低的温度。 - 酰化的酯类、酮和腈
Peter j . Garratt布莱恩·r·戴维斯
合成1991年,2,795 - 863
DOI:10.1016 / b978 - 0 - 08 - 052349 - 1.00050 - 0
本文综述了克莱森和Dieckmann冷凝,以及其他相关的化学反应。 - Enantiospecific合成Carbapentostatins
乔纳森·z Ho Rafat m . Mohareb锦安,Tae Bo Sim,亨利•拉波波特
《有机化学》杂志上2003年,68年(1),109 - 114
DOI:10.1021 / jo020612x
Dieckmann凝结也实用工具在现代有机合成中,因为它可以用作一个环状结构(措施)的反应,我们可以看到在这个总合成教授亨利•拉波波特(加州大学伯克利分校)。
这就跟你问声好!小问题,如果酯用强碱处理不会是皂化反应而不是?
嗨,如果酯治疗氢氧离子HO(-),将它转换成一个羧酸(然后羧酸盐盐)皂化。
如果酯醇盐基地RO(-)处理可能发生的一件事是不皂化,但* transesterificaation *这是一个亲核酰取代反应。例如CH3COOCH3 + NaOCH2CH3可以给CH3COOCH2CH3 + NaOCH3。
为了避免在克莱森酯交换我们通常添加基础和任何附加到酯一样。
我不明白- RO为什么不只是攻击在c = o碳亲核加成反应的第一步?
它可以,但是它是可逆的。像驱车沿着一条死胡同,这最终将会扭转,去别的地方。
我将访问pdf指南如果我支付每月的课程?
不,pdf指南是一次性下载,而每月订阅是指导和测验的反应,这可能是太大下载。